1、实验题 乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 °C,沸点:180.8℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:2CH3COOC2H5 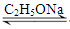 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
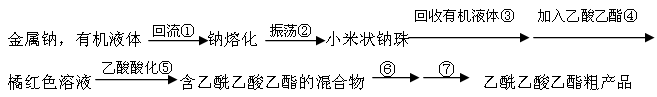
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
?
| 钠
| 苯
| 甲苯
| 对二甲苯
| 四氯化碳
|
密度(g/cm3)
| 0.97
| 0.88
| 0.87
| 0.86
| 1.60
|
熔点(℃)
| 97.8
| 5.5
| -95
| 13.3
| -22.8
|
沸点(℃)
| 881.4
| 80
| 111
| 138. 4
| 76.8
|
?
最好选用?来熔化钠。是否能用四氯化碳??(填“是”或“否”)理由是?。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是?。烧瓶配上长导管的作用是?,导管上端接一干燥管的目的是?。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是?,写出步骤⑦实验操作的主要仪器?(填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。
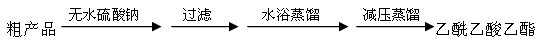
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是?。
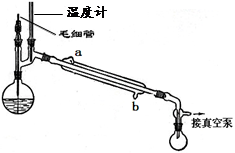
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。冷凝管的进出水方向应?口进,?口出。毛细管的作用是?。
参考答案:(1)对二甲苯 (1分)否(1分) 四氯化碳的沸点比钠的熔点低。(2分)(说明:填“钠浮在四氯化碳上面易被空气氧化”只能得1分)
(2)有水则钠和水反应生成NaOH,使乙酸乙酯水解 ,(2分) 导气及冷凝回流, (1分)?防止空气中的水蒸气进入烧瓶 。(1分)
(3)使乙酰乙酸乙酯分层析出(分层);(1分)(注:NaCl作用有增加溶液密度,降低酯溶解度等作用,使酯更易分层析出)分液漏斗?。(1分)
(4)干燥水分?。(1分)
(5)b?,a 。(1分,说明:两空共1分,均正确才给分)平衡压强、提供汽化中心、防暴沸。(2分,说明:任意答出一点即给满分)
本题解析:(1)为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,则有机物的密度应比Na的小,并且沸点比Na的熔点高才符合,由于苯的沸点和钠的熔点相差较小,应用对二甲苯;故答案为:对二甲苯;否;四氯化碳的沸点比钠的熔点低;
(2)因钠易与水反应,生成NaOH,使乙酸乙酯水解,则原料乙酸乙酯必须无水,烧瓶配上长导管可起到与空气充分热交换的作用,使蒸汽充分冷凝,实验必须在无水的环境中进行,可在导管上端接一干燥管,故答案为:有水则钠和水反应生成NaOH,使乙酸乙酯水解;导气及冷凝回流;防止空气中的水蒸气进入烧瓶;
(3)乙酰乙酸乙酯难溶于饱和食盐水,可使生成的有机物分层,可用分液漏斗分离;故答案为:使乙酰乙酸乙酯分层析出(分层);分液漏斗;
(4)无水硫酸钠固体具有吸水的作用,故答案为:干燥水分;
(5)蒸馏时,应从冷凝管的下口进水,上口出水,可使冷水充满冷凝管,起到充分冷凝的作用,毛细管的起到平衡压强、提供汽化中心、防暴沸的作用,故答案为:b,a;平衡压强、提供汽化中心、防暴沸;
本题难度:困难
2、选择题 从海水中可以提取溴,但得到的液溴中常常溶有少量氯气, 除去氯气应该采用的方法是
[? ]
A.加适量的KI溶液
B.通入溴蒸气
C.加入适量的NaOH溶液
D.加入适量的NaBr溶液
参考答案:D
本题解析:
本题难度:一般
3、选择题 为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是?
[? ]
A.NaOH
B.Na2CO3
C.氨水
D:MgO
参考答案:D
本题解析:
本题难度:一般
4、实验题 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为________________。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
实验序号
| 实验
| 实验现象
| 结论
|
实验Ⅱ
| 将实验Ⅰ中收集到的气体点燃
| 能安静燃烧、产生淡蓝色火焰
| ①气体成分为________
|
实验Ⅲ
| ②取实验Ⅰ中的白色不溶物,洗涤,加入足量________
| ③________________
__________________
__________________
| 白色不溶物可能含有MgCO3
|
实验Ⅳ
| 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液
| 产生白色沉淀
| ④溶液中存在________
|
?
(3)为进一步确定实验Ⅰ的产物,设计定量实验方案,如图所示:
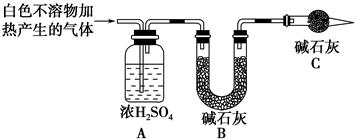
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式:__________________________ ______________________________________________。
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:____________________________________。
参考答案:(1)Mg(OH)2
(2)①氢气 ②稀盐酸(合理均可) ③产生气泡,沉淀全部溶解 ④CO32—
(3)2MgCO3·Mg(OH)2或Mg(OH)2·2MgCO3或Mg3(OH)2(CO3)2
(4)NaHCO3溶液中存在平衡:HCO32— H++CO32—、H2O
H++CO32—、H2O H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—反应生成难溶物Mg(OH)2·2 MgCO3,则H+、OH-、CO32—的浓度均减小,促使上述两平衡均向右移动
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—反应生成难溶物Mg(OH)2·2 MgCO3,则H+、OH-、CO32—的浓度均减小,促使上述两平衡均向右移动
本题解析:(1)镁与饱和碳酸氢钠溶液的反应,生成H2和白色不溶物,白色不溶物可能是Mg(OH)2或MgCO3或[xMgCO3·yMg(OH)2]。(2)能安静燃烧、产生淡蓝色火焰的是氢气;MgCO3中加入稀盐酸,沉淀全部溶解,产生气泡;加入氯化钙溶液,有白色沉淀生成,证明含有CO32—。(3)浓硫酸增重说明生成物中有H2O,碱石灰增重说明生成物中有CO2,且Mg(OH)2与MgCO3的物质的量之比为1∶2。(4)溶液中存在HCO3— H++CO32—和H2O
H++CO32—和H2O H++OH-,Mg与H+反应生成H2和Mg2+,Mg2+与CO32—、OH-反应生成沉淀Mg(OH)2·2MgCO3,两平衡均正向移动。
H++OH-,Mg与H+反应生成H2和Mg2+,Mg2+与CO32—、OH-反应生成沉淀Mg(OH)2·2MgCO3,两平衡均正向移动。
本题难度:困难
5、选择题 下列物质液体混合用分液漏斗能分离两组分的是( )
A.乙醇和乙酸
B.乙醛和水
C.甲苯和水
D.苯和溴苯
参考答案:A.乙酸和乙醇混合后不分层,用分液漏斗不能分离,故A不选;
B.乙醛和水混合后不分层,用分液漏斗不能分离,故B不选;
C.甲苯和水混合后分层,用分液漏斗能分离,故C选;
D.溴苯和苯互混合后不分层,用分液漏斗不能分离,故D不选;
故选C.
本题解析:
本题难度:一般