1、选择题 某溶液经分析除含大量H+外,还有Ba2+和Fe2+,则该溶液中还可能大量存在的离子是
A.SO42-
B.OH-
C.NO3-
D.Cl-
参考答案:D
本题解析:分析:根据离子之间不能结合生成沉淀、水、气体,不能发生氧化还原反应,则离子才能大量共存,以此来解答.
解答:A.因Ba2+和SO42-结合生成硫酸钡沉淀,则不能共存,故A错误;
B.因H+和OH-结合生成水,Fe2+和OH-结合生成沉淀,则不能共存,故B错误;
C.因H+和Fe2+、NO3-发生氧化还原反应,则不能共存,故C错误;
D.已知溶液中的离子之间不反应,且均不与反应Cl-,则能大量共存,故D正确;
故选D.
点评:本题考查离子的共存,熟悉题目中的隐含信息及离子之间的反应是解答本题的关键,题目难度不大.
本题难度:困难
2、填空题 (13分)(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则:
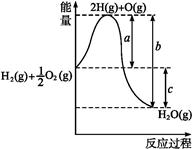
①a、b、c分别代表什么意义?
a
b
c
②该反应是 反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 ,
。(请写两条)
(3)已知:H2(g)+1/2O2(g) H2O(l) ΔH="-285.8" kJ·mol-1
H2O(l) ΔH="-285.8" kJ·mol-1
H2(g) H2(l) ΔH="-0." 92 kJ·mol-1
H2(l) ΔH="-0." 92 kJ·mol-1
O2(g) O2(l) ΔH="-6.84" kJ·mol-1
O2(l) ΔH="-6.84" kJ·mol-1
H2O(l) H2O(g) ΔH="+44.0" kJ·mol-1
H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:
参考答案:(1)①1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量;H、O结合生成1 mol H2O(g)放出的热量;1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量;②放热 <;(2)相同质量时,氢气放出的热量多 产物为水,无污染(其他合理答案均可);(3)H2(l)+O2(l) H2O(g) ΔH="-237.46" kJ·mol-1。
H2O(g) ΔH="-237.46" kJ·mol-1。
本题解析:
试题解析:(1)图象中可以分析判断,a代表旧键断裂吸收的能量;c为反应生成化学键放出的热量减去反应断裂化学键吸收的热量,即c代表反应热;(2)反应物的能量高于生成物的能量,依据化学反应的能量守恒,反应是放热反应,焓变小于0;(2)氢气在氧气中可以燃烧可以放出大量的热,氢气的燃烧产物是水,不污染环境;(3)已知:①H2(g)+1/2O2(g)
本题难度:困难
3、选择题 下列叙述正确的是(?)
A.离子化合物中一定含有金属元素
B.金属元素不可能存在于阴离子中
C.含有非极性键的化合物不一定是共价化合物
D.由两种元素构成的共价化合物分子中的化学键都是极性键
参考答案:C
本题解析:A.离子化合物中不一定含有金属元素,如NH4Cl是离子化合物,但是没有金属阳离子。错误。B.金属元素可能存在与阳离子中也可能存在于阴离子中。如NaCl、NaAlO2等离子化合物中。C.非极性键可能存在与单质如H2、共价化合物如H2O2,也可能存在与离子化合物中如Na2O2。因此含有非极性键的化合物不一定是共价化合物。正确。D.由两种元素构成的共价化合物分子中的化学键既可能是极性键,也可能是含有非极性共价键。如H2O中的共价键为极性共价键。在H2O2中的H—O键是极性共价键;O—O键是非极性共价键。错误。
本题难度:一般
4、选择题 强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l); △H=-57.3 kJ·mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ·mol-1,
1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ;△H=-Q2 kJ·mol-1
HNO3(aq)+KOH(aq)= KNO3(aq)+H2O(l);△H=-Q3 kJ·mol-1
则Q1、Q2、Q3的关系正确的是
A.Q2 > Q3 > Q1
B.Q2 > Q1 > Q3
C.Q1 = Q2 = Q3
D.Q2 = Q3 > Q1