|
高考化学知识点总结《化学基本概念》考点特训(2020年冲刺版)(二)
2021-02-18 07:08:14
【 大 中 小】
|
1、选择题 工业制ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是
A.NaClO3在反应中化合价降低,失去电子
B.SO2在反应中发生氧化反应
C.1mol氧化剂在反应中得到2mol电子
D.H2SO4 在反应中作氧化剂
参考答案:
本题解析:
本题难度:困难
2、选择题 厨房中的化学知识很多,下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C.豆浆久置变质腐败
D.用食醋除去保温瓶胆内的水垢
|
参考答案:D
本题解析:铁锅出现红棕色斑迹是因为铁和空气中的氧气发生了反应,是氧化还原反应,沼气燃烧是氧化还原反应,所有的燃烧都是氧化还原反应反应,豆浆久置变质腐败是因为豆腐被空气中的氧气氧化了,也是氧化还原反应,食醋与水垢反应是复分解反应,不属于氧化还原反应,选D。
考点:生活中的化学现象和氧化还原反应的关系。
本题难度:一般
3、填空题 高温条件下,辉铜矿(主要成分为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。
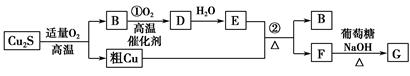
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。
参考答案:(1)Cu2S+O2(适量) 2Cu+SO2 O2和Cu2S 2Cu+SO2 O2和Cu2S
(2)Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O
(3)粗铜 硫酸铜或含Cu2+的盐溶液
(4)3∶7
本题解析:(1)根据图示,Cu2S与O2的反应为氧化还原反应,结合B与O2的反应条件,可以推断B为SO2,该反应为Cu2S+O2(适量) 2Cu+SO2。反应中Cu、O的化合价降低,因此氧化剂为O2和Cu2S。(2)B为SO2,则D为SO3,E为H2SO4。反应②为Cu+2H2SO4(浓) 2Cu+SO2。反应中Cu、O的化合价降低,因此氧化剂为O2和Cu2S。(2)B为SO2,则D为SO3,E为H2SO4。反应②为Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。(3)电解精炼铜时,粗铜作阳极,含Cu2+的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。 CuSO4+SO2↑+2H2O。(3)电解精炼铜时,粗铜作阳极,含Cu2+的盐溶液作电解质溶液。(4)根据化学方程式中硫元素的化合价变化,可知被氧化的硫和被还原的硫的质量比为3∶7。
本题难度:困难
4、选择题 欲除去氯气中少量的氯化氢气体,可选用的试剂是
A.饱和食盐水
B.硝酸银溶液
C.氢氧化钠溶液
D.饱和碳酸钠溶液
参考答案:A
本题解析:分析:氯气难溶于饱和食盐水,HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体.
解答:因氯气与水发生:Cl2+H2O H++Cl-+HClO,则氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,氯气和氯化氢都能与硝酸银溶液、氢氧化钠溶液、饱和碳酸钠溶液反应,不能用于除杂,故选A. H++Cl-+HClO,则氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,氯气和氯化氢都能与硝酸银溶液、氢氧化钠溶液、饱和碳酸钠溶液反应,不能用于除杂,故选A.
点评:本题考查气体的除杂问题,题目难度不大,本题注意除杂时不能影响被乙醇问题的性质.
本题难度:困难
5、选择题 理论上不能用于设计成原电池的反应是
A.HCl+NaOH===NaCl+H2OΔH<0
B.2CH3OH(l)+3O2(g)===2CO2(g )+4H2O(l)ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)===4 Fe(OH)3(s)ΔH<0
D.2H2(g)+O2(g)===2H2O(l) ΔH<0
参考答案:A
本题解析:原电池中要产生电流,而电流的产生离不开电子的运动,所以只有自发的氧化还原反应才能设计成原电池,选项A中反应是中和反应,不是氧化还原反应,因此不能设计成原电池,其余都是可以的,答案选A。
本题难度:简单
|