1、选择题 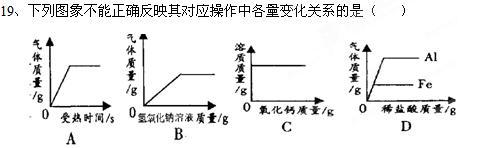
A.用一定质量的高锰酸钾加热制氧气
B.向一定质量的硫酸铵溶液中加入过量的氢氧化钠溶液
C.向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体
D.分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量
2、推断题 Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素;?
②Y原子价电子排布msnmpn?
③R原子核外L层电子数为奇数;?
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z的元素符号为_______,在周期表中的____?分区。
(2)?向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为___________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有__________(填序号)。?
?A?配位键?B?极性共价键?C?非极性共价键?D?离子键?
(3)氢化物的沸点:X的比同族其它元素高的原因是____________。Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是______________(填序号)。
a.稳定性:甲>乙,沸点:甲>乙?b.稳定性:甲>乙,沸点:甲<乙 c.稳定性:甲<乙,沸点:甲<乙?d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为_______________。R、X、Y四种元素的原子半径由小到大的顺序为____________(均用元素符号表示)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为____________。
3、填空题
族
周期 | IA | | 0
1
H
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
He
2
Li
Be
B
C
N
O
F
Ne
3
Na
Mg
Al
Si
P
S
Cl
Ar
|
上表为1~18号元素.有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的最外层电子数为最内层电子数的2倍;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一.
(1)试推断它们各是什么元素,写出它们的元素符号:
A______、B______、C.______、D______、E______.
(2)写出A分别与B、C、D所形成化合物的化学式:______、______、______
(3)写出A、C、D形成的化合物与A、D、E形成的化合物间相互反应的化学方程式.______.
4、简答题 下列有关比较中,大小顺序排列错误的是( )
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰
C.结合H+的能力:CO32->CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
5、选择题 Na2O2、Cl2、SO2等均能使品红溶液褪色。下列说法正确的是
A.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质
B.标准状况下,1 mol Na2O2和22.4LSO2反应生成Na2SO4,转移电子数目为NA
C.等物质的量Cl2和SO2同时通入品红溶液,褪色更快
D.在Na2O2中阴阳离子所含的电子数目相等