1、填空题 一氧化碳是一种重要的化工原料.
(1)高炉炼铁中发生的反应之一是:FeO(s)+CO(g)
Fe(s)+CO2(g),△H=-1kJ/mol.温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将______(填“增大”、“减小”或“不变”).
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应______.
A.向正反应向向进行?B.处于平衡状态?C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去.在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)?K=1.0,若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为______.
(3)用CO和H2经如下两步反应制得甲酸甲醛:CO+2H2→CH3OH,CO+CH3OH→HCOOCH3已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52tCO最多可制得甲酸甲醛多少吨?(写出计算过程).
参考答案:(1)反应放热,升高温度平衡向逆反应方向移动,则平衡常数应减小,(CO2)=0.025mol/L,c(CO)=0.1mol/L,
Q=0.0250.1=0.25<0.263,反应向正反应方向进行,
故答案为:减小;A;
(2)若平衡时n(H2O)/n(CO)=1,根据反应方程式可知,起始时H2O和CO物质的量相等,设H2O和CO的物质的量都为1mol
平衡时转化xmolCO,
? ?CO(g)+H2O(g)?△?.??CO2(g)+H2(g)
起始(mol):1? 1? 0? 0
转化(mol):x? x?x? x
平衡(mol):1-x? 1-x? x? x
则x2(1-x)2=1,
x=0.5,
则CO转化为CO2的转化率为0.51×100%=50%,
故答案为:50%;
(3)n(CO)=2.52×106g28g/mol=9×104mol,
设用于制备甲醇的CO物质的量为x,用于和甲醇反应的CO为y,
则
本题解析:
本题难度:一般
2、填空题 (10分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K =?。
(2)该反应为?反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是?。
a.容器中压强不变? b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O)? d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ?℃。
参考答案:(共10分)
(1)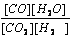 ;(4分)(2)吸热;(2分)
;(4分)(2)吸热;(2分)
(3)b、c;(2分) (4)830? (2分)
本题解析:CO2(g)+H2(g) CO(g)+H2O(g),该反应的化学平衡常数表达式为K =
CO(g)+H2O(g),该反应的化学平衡常数表达式为K =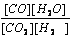 ?;
?;
随着温度升高,K值增大,,说明平衡向正向移动,所以该反应为吸热反应;
能判断该反应是否达到化学平衡状态的依据是b、c。
a.容器中压强不变? b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O)? d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),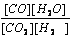 =1所以此时的温度为 830℃
=1所以此时的温度为 830℃
点评:在书写平衡常数表达式时,要注意以下问题:
① 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL。水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。
对于非水溶液中的反应,溶剂的浓度同样是常数。
② 当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度。
③ 化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同。但是这些平衡常数可以相互换算。
④ 不同的化学平衡体系,其平衡常数不一样。平衡常数大,说明生成物的平衡浓度较大,反应物的平衡浓度相对较小,即表明反应进行得较完全。因此,平衡常数的大小可以表示反应进行的程度。
⑤一般认为K>10^5反应较完全(即不可逆反应),K<10^(-5)反应很难进行(即不反应)。
平衡常数的数值大小可以判断反应进行的程度。
本题难度:一般
3、填空题 (6分)如图所示,某温度下,物质的量分别是1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min后测得n(X) =0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的反应物为?该反应的化学方程式可表示为??,反应在10分钟内的化学反应速率用Z来表示则V(Z)=?。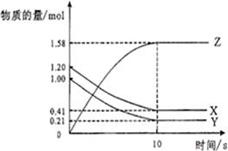
参考答案:X?和 Y ;? X + Y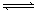 2Z ;? 0.079 mol /(L·min)
2Z ;? 0.079 mol /(L·min)
本题解析:由图像可知X和Y的物质的量减少,Z的物质的量增加,所以X和Y是反应物,Z是生成物。到达平衡时X、Y、Z的物质的量的变化量分别是0.79mol、0.79mol、1.58mol,因为变化量之比就是相应的化学计量数之比,所以方程式为X + Y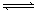 2Z。反应速率通常用单位时间内浓度的变化量来表示,所以用Z表示的反应速率是
2Z。反应速率通常用单位时间内浓度的变化量来表示,所以用Z表示的反应速率是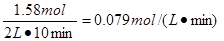 。
。
本题难度:一般
4、选择题 定条件下,存在可逆反应X(g)+2Y(g)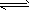 3Z(g),若X、Y、Z起始浓度分别为
3Z(g),若X、Y、Z起始浓度分别为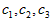 (均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是
(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是
[? ]
A.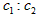 =l:2
=l:2
B.达平衡状态时,生成Z的速率是生成X速率的3倍
C.X、Y的转化率不相等
D.C2的取值范围为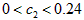
参考答案:C
本题解析:
本题难度:一般
5、选择题 在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A.等于0.6mol
B.等于1mol
C.大于0.6mol且小于1mol
D.大于1mol
参考答案:C
本题解析:增大水蒸气的浓度,平衡向正反应方向移动,通过CO的转化率,所以平衡时CO2的物质的量大于0.6mol。但由于是可逆反应,所以转化率达不到100%,因此CO2的浓度小于1.0mol。答案选C。
本题难度:一般