1、选择题 把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
[? ]
A.SO2
B.Cl-
C.Fe3+
D.NO3-
参考答案:D
本题解析:解析:
铁离子具有氧化性,能把SO2氧化生成硫酸,从而生成硫酸钡沉淀。铁离子被还原生成亚铁离子。但在酸性溶液中NO3-具有氧化性,能把亚铁离子氧化生成铁离子, 所以最终被还原的是NO3-,故D正确。
故选:D
本题难度:一般
2、选择题 已知Fe有三种常见的氧化物FeO,Fe2O3,Fe3O4,其中Fe3O4可看成是FeO·Fe2O3,而铁的常见价态有+2和+3价,Fe2+遇到稀硝酸则发生氧化还原反应生成Fe3+和NO。写出上面三种氧化物和稀硝酸反应的方程式。
参考答案:3FeO+10HNO3(稀)====3Fe(NO3)3+NO↑+5H2O
Fe2O3+6HNO3(稀)====2Fe(NO3)3+3H2O
3Fe3O4+28HNO3(稀)====9Fe(NO3)3+NO↑+14H2O
本题解析:Fe3O4看成另外两种氧化物的混合物,先写出其他两种与稀硝酸的反应,再相加即可。
本题难度:简单
3、选择题 实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸上颜色发生变化所用去的时间 来判断空气中的含汞量,其反应为:4CuI +Hg =Cu2HgI4+2Cu,下列说法正确的是
[? ]
A.CuI在反应中失去电子
B.Cu2HgI4中Cu元素的化合价为+2
C.CuI是发生还原反应
D.1 molCuI参与反应有1 mol电子转移
参考答案:C
本题解析:
试题分析:
选项A,CuI在反应中,Cu化合价降低,得到电子
选项B,Cu2HgI4中Cu元素的化合价为+1价
选项C,CuI中Cu化合价降低,得到电子,发生还原反应
选项D,4molCuI参与反应有2mol电子转移,,1molCuI参与反应有0.5mol电子转移
故选:C
本题难度:简单
4、填空题 (1)2008年9月25日,“神舟七号”载人航天飞船在酒泉卫星发射中心成功发射升空。航天飞船曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
(1)写出其中涉及的化学方程式:_____________;____________。
(2)高氯酸铵作为火箭燃料的重要供氧剂。高氯酸铵在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式:____________________。
②反应中生成的氧化产物与还原产物的物质的量之比是__________,每分解1 mol高氯酸铵,转移的电子数目是__________。
参考答案:(1)4Al+3O2 2Al2O32NH4ClO4
2Al2O32NH4ClO4 N2↑+4H2O↑+Cl2↑+2O2↑
N2↑+4H2O↑+Cl2↑+2O2↑
(2)①4NH4ClO4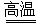 6H2O↑+2N2↑+4HCl↑+5O2↑
6H2O↑+2N2↑+4HCl↑+5O2↑
②7∶48NA或8×6.02×1023
本题解析:(1)铝粉在加热被氧化时放出大量热量使高氯酸铵分解,结合题给信息产物为N2、H2O、Cl2、O2。由元素守恒可知方程式为2NH4ClO4 N2↑+4H2O↑+Cl2↑+2O2↑。
N2↑+4H2O↑+Cl2↑+2O2↑。
(2)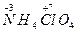 在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4
在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4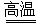 6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
本题难度:简单
5、选择题 高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:
Fe(OH)3+ClO-+OH- 一FeO42-+Cl- +H2O(未配平),在上述反应中(? )
A.FeO42-是还原产物
B.ClO-是还原剂
C.1molFe(OH)3得到3mol电子
D.配平后OH- 的化学计量数为4
参考答案:D
本题解析:略
本题难度:一般