1、实验题 (15)用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用
A.10 mL B.25 mL C.50 mL D.1 00 mL)。
00 mL)。
(2)第③步实验的操作是________________________________(具体操作方法)(2分)。
(3)第⑤步实验的操作是________________________________(具体操作方法)(2分)。
(4)第④步实验操作的目的是________________________________(2分)。
(5)溶液转 移到容量瓶之前需要恢复到室温是因为_______________________________
移到容量瓶之前需要恢复到室温是因为_______________________________ _(2分)。
_(2分)。
(6)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)?A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________?
D.定容时俯视刻度线________________
E .定容时加蒸馏水不慎超过了刻度_______________
.定容时加蒸馏水不慎超过了刻度_______________
参考答案:

本题解析:略
本题难度:一般
2、选择题 下列实验操作中,所使用的有关仪器不要求干燥的是
A.收集氯化氢的集气瓶
B.用氯化氨和熟石灰混合加热制氨气时所用的试管
C.用氨气做喷泉实验时用来收集氨气的烧瓶
D.配制一定物质的量浓度溶液时所用的容量瓶
参考答案:A
本题解析:略
本题难度:一般
3、选择题 一些化学试剂瓶上贴有危险警告标志,下列物质的试剂瓶上所贴化学品标志有错误的是
?
| A
| B
| C
| D
|
物质
| NaHCO3
| 黑火药
| 浓H2SO4
| KMnO4
|
危险警告标识
| 
| 
| 
| 
|
?
参考答案:A
本题解析:NaHCO3是有腐蚀性的试剂,不是有毒的试剂。错误。其它各个标示与试剂都相吻合。
本题难度:简单
4、实验题 过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还 可以作为鱼池增氧剂。査阅文献:过氧化钙的制备方法一般有两种方案。利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2·8H2O沉淀。已知CaO2·8H2O呈白色,微溶于水,在60℃下烘0.5小时可形成CaO2·2H2O,再在 140℃下烘0.5小时,得无水CaO2。加热至350℃左右开始分解放出氧气。
已知某化工厂生产过氧化钙的主要工艺流程如下:

某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是:??。
(2)检验“水洗”是否合格的方法是:??。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
②??。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a? g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为??。
②CaO2的质量分数为??(用字母表示)
参考答案:(1)CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl (3分)
(2)取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。(2分)
(3)②温度低可减少过氧化氢的分解,提高过氧化氢的利用率。(2 分)
(4)①最后一滴Na2S2O3溶液滴下时,溶液蓝色刚好褪去,且30s内(或半分钟内)不恢复蓝色(2 分)
②?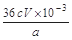 ?(3分)
?(3分)
本题解析:
(1)根据题意,CaCl2在碱性条件下和H2O2反应,利用CaO2?H2O溶解度不大而析出。
(2)检验“洗涤”是否合格,需要取最后一次洗涤液,检验其中是否存在杂质离子Cl-。
(3)反应时需要用的H2O2,因此反应温度不能过高。
(4)根据电子转移守恒关系可知:
CaO2?~ ?I2 ?~ ?2S2O32-
m? c×V×10-3mol
因此m%=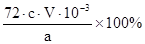
本题难度:一般
5、填空题 (一)实验室用Na2CO3·10H2O配制500ml 0.10mol·L-1的Na2CO3溶液,填空并请回答下列问题:
(1)根据实验要求填表:
应量取Na2CO3·10H2O的质量/g
| 应选用容量瓶的规格/mL
| 除容量瓶外还需要的其它玻璃仪器
|
?
| ?
| ?
|
?
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)?;
A.用适量水洗涤烧杯2—3次,洗涤液均注入容量瓶中,振荡。
B.用托盘天平准确称量所需Na2CO3·10H2O的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(需要时可加热)。
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作?;若加蒸馏水时不慎超过了刻度?;若定容时俯视刻度线?。
(二)喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据下图,回答下列问题:
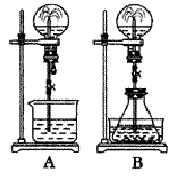
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是(?)。?
A.HCl和H2O?B.Cl2和NaOH溶液?
C.HCl和汽油?D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷?泉的是(?)
A.Cu与稀盐酸?B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸? D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是(?)。
A.浓硫酸? B.生石灰? C.硝酸铵? D.烧碱
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是_______上部烧瓶内压强;城市中常见的人造喷泉及火山爆发的原理与上述________(填图A或图B)装置的原理相似。
参考答案:(一)(1)根据实验要求填表:
应量取Na2CO3·10H2O的质量/g
应选用容量瓶的规格/mL
除容量瓶外还需要的其它玻璃仪器
14.3
500
烧杯、玻璃棒、胶头滴管(2分)
?
(2)BCAFED;(2分)
(3)偏低; 偏低; 偏高。
(二)(1)C?(2)D?(3) C?(4) 减小?、 B
本题解析:(一)(1)n(Na2CO3)=0.5L·0.10mol·L-1=0.05mol,所以
m(Na2CO3·10H2O)=0.05mol·286g/mol=14.3g,应选用500ml的容量瓶,还需要烧杯、玻璃棒、胶头滴管玻璃仪器;
(2)根据配制溶液的步骤:称量、溶解、移液、洗涤、定容、摇匀,可得正确的操作顺序是BCAFED;
(3)缺少洗涤步骤会使结果偏低;加水超过刻度线使溶液体积增大,配制结果偏低;定容时俯视刻度线会使配制结果偏高。
(二) ⑴A形成喷泉的原因是烧瓶内压强减小,外界气压将烧杯内液体压入烧瓶,A、B、D中均是气体易溶于液体或与液体反应,可使烧瓶内外产生较大压强差,C、氯化氢不溶于汽油,所以不会产生喷泉,答案选D;
⑵B形成喷泉的原因是锥形瓶内产生气体使瓶内压强增大,将液体压入烧瓶内。A、B不会产生气体,错误;C、虽然会产生气体,但是生成的硫酸钙是微溶物,不利于气体的产生,烧瓶内外压强差别不大,不会形成喷泉,错误;D、产生大量氨气使锥形瓶内压强增大,形成喷泉,答案选D;
⑶水槽内所加物质应是产生热量的物质使锥形瓶内温度升高,压强增大。A、B、D、溶于水时均放热,正确;C、溶于水时吸热使体系温度降低,错误,答案选C;
⑷比较A、B,A是减小烧瓶上部压强,B是增大下部压强;人造喷泉及火山爆发的原理与上述B图相似。
本题难度:一般