1、选择题 下列气态氢化物中最稳定的是
A.CH4
B.HCl
C.H2S
D.SiH4
参考答案:B
本题解析:Cl的非金属最强,所以构成的气态氢化物最为稳定。
本题难度:简单
2、填空题 根据题意回答下列问题
①Fe2+的电子排布式为?②基态铜原子简化电子排布式为?
③Se价电子排布图为?④第二周期第一电离能由小到大的次序为?
⑤铬原子的原子结构示意图为?
参考答案:①1s22s22p63s23p63d6 ②[Ar]3d104s1
③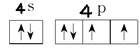 ? ④Li B Be C O N F Ne ⑤
? ④Li B Be C O N F Ne ⑤
本题解析:①根据构造原理可写出电子的排布式为1s22s22p63s23p63d6
②因为全充满或半充满是稳定的,所以基态铜原子简化电子排布式为[Ar]3d104s1
③根据泡利原理、洪特规则和能量最低原理可知,Se价电子排布图为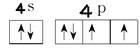
④非金属性越强,第一电离能越大,但由于和Be和N属于全充满或半充满状态,稳定性强,所以第二周期第一电离能由小到大的次序为Li B Be C O N F Ne。
⑤铬原子属于第四周期第ⅤB,原子结构示意图为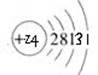 。
。
本题难度:一般
3、填空题 (12分)①~⑧是元素周期表中的部分元素。
 族 族
周期
| IA
| ?
| 0
|
1
| ①
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| ?
|
2
| ?
| ?
| ?
| ②
| ?
| ③
| ④
| ?
|
3
| ⑤
| ⑥
| ⑦
| ?
| ?
| ?
| ⑧
| ?
|
请回答:
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式)。
(2)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是__________。
(3)元素⑥和⑧形成的化合物的电子式是__________。
(4)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。请回答:
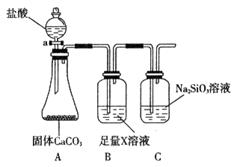
a. X是__________(填化学式),B装置的作用是__________。
b. 能说明元素②和硅元素非金属性强弱的实验现象是__________,相关的化学方程式是__________。同主族元素从上到下__________,得电子能力逐渐减弱,非金属性逐渐减弱。
(5)请设计实验比较元素⑥与⑦金属性的相对强弱__________。
参考答案:(1)HF(1分,写F不给分)
(2) (2分,写化学方程式或没配平不给分)
(2分,写化学方程式或没配平不给分)
(3)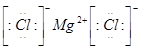 (1分)?(4)a.
(1分)?(4)a. 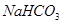 (1分)
(1分)
吸收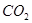 中混有的
中混有的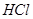 气体(1分)? b. C中产生白色胶状沉淀(1分)
气体(1分)? b. C中产生白色胶状沉淀(1分)
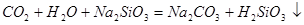 (2分,写
(2分,写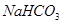 、离子方程式均给分)
、离子方程式均给分)
电子层数逐渐增加,原子半径逐渐增大(1分,任答一点即可)
(5)取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。(2分,未注明酸浓度相同扣1分,其他合理答案,如与热水、原电池、最高价氧化物的水化物的碱性比较等酌情给分,但答成原理不给分)
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑧分别是H、C、O、F、Na、Mg、Al、Cl。
(1)非金属性越强相应氢化物的稳定性越强,所以应该是HF。
(2)氢氧化铝是两性氢氧化物,能溶于氢氧化钠中,方程式为 。
。
(3)镁和氯都是活泼的金属和非金属,二者形成的化学键是离子键,电子式为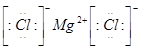
(4)A装置是产生CO2的,但由于生成CO2分子中含有氯化氢,而氯化氢也能和硅酸钠反应,所以需要除去CO2中的氯化氢,因此X是碳酸氢钠,原来吸收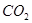 中混有的
中混有的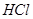 气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为
气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为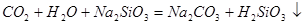 。
。
(5)考查金属性强弱比较。比较元素金属性强弱的依据可以是
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
即取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。
本题难度:一般
4、选择题 下列说法正确的是
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
参考答案:B
本题解析:A不正确,应该是同一周期的ⅠA族元素的金属性比ⅡA族元素的金属性强;C不正确,应该是同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强;D不正确,第三周期元素的阳离子半径小于后面阴离子半径,答案选B。
点评:该题是中等难度的试题,试题基础性强,贴近高考,难易适中。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:简单
5、选择题 下列各微粒不属于等电子体的是(? )
A.NO2+和 CO2
B.CO32- 和 SO2
C.O3和NO2-
D.SO42-和PO43-
参考答案:B
本题解析:电子数和原子数都相等的分子是等电子体,B中原子数不相等,不属于等电子体,其余都是正确的,答案选B。
本题难度:简单