1、选择题 关于合金性质的说法中,错误的是( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的物理性质不同
D.合金的化学性质一般与其各成分金属的化学性质不同
参考答案:D
本题解析:
本题难度:简单
2、填空题 (1)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质,其原因是_____________________________。
(2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
参考答案:(1)氯气杀菌、亚铁盐水解产生的胶体吸附悬浮杂质?
(2)加氨后,次氯酸的释放经可逆反应:NH3+HClO H2O+NH2Cl后相当于缓释作用
H2O+NH2Cl后相当于缓释作用
本题解析:(1)Cl2与FeSO4·7H2O同时使用可以改善水质的原因为:Cl2+H2O HCl +HClO,HClO具有强氧化性,能杀死水中的细菌,起消毒的作用。
HCl +HClO,HClO具有强氧化性,能杀死水中的细菌,起消毒的作用。
Cl2还可将Fe2+氧化成Fe3+:Cl2+2Fe2+====2Cl-+2Fe3+。Fe3+水解:Fe3++3H2O Fe(OH)3+3H+,生成Fe(OH)3胶体。Fe(OH)3胶体具有较强的吸附性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。
Fe(OH)3+3H+,生成Fe(OH)3胶体。Fe(OH)3胶体具有较强的吸附性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。
(2)根据(1)中的分析,起杀菌消毒作用的是HClO,由题意可知NH2Cl的稳定性大于HClO,向含有Cl2的自来水加入NH3之后会发生如下反应:HClO+NH3 H2O+NH2Cl,从而使不稳定的HClO部分转化为较稳定的NH2Cl。在消毒过程中,随着HClO浓度的降低,上述平衡将向左移动,HClO得以补充,从而延长了液氯的杀菌时间。
H2O+NH2Cl,从而使不稳定的HClO部分转化为较稳定的NH2Cl。在消毒过程中,随着HClO浓度的降低,上述平衡将向左移动,HClO得以补充,从而延长了液氯的杀菌时间。
本题难度:简单
3、选择题 下列叙述中,不正确的是?
[? ]
A.光导纤维的主要成分是高纯度的二氧化硅
B.为防止电池中重金属离子污染土壤和水源,废电池要集中处理
C.用氯气给自来水消毒可能生成对人体有害的有机氯化物 ?
D.硫的氧化物、氮的氧化物是形成酸雨的主要物质,酸雨的主要成分是硝酸和亚硫酸
参考答案:D
本题解析:
本题难度:简单
4、简答题 最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功.具体生产流程如下:
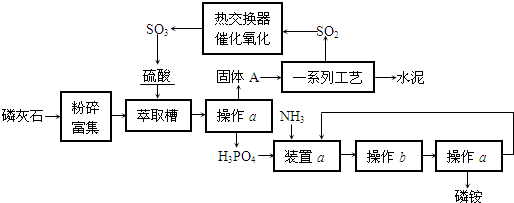
回答下列问题:
(1)若操作a、操作b均在实验室进行,则操作a时用到的玻璃仪器有______;进行操作b时需注意______.
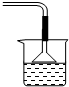
(2)装置a用磷酸吸收NH3.若该过程在实验室中进行,请画出装置a的示意图.
(3)热交换器是实现冷热交换的装置.化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______.
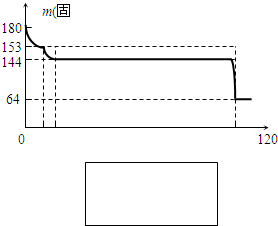
(4)固体A为生石膏(CaSO4?2H2O)和不含结晶水且高温时也不分解的杂质.生石膏在120℃时失水生成熟石膏(2CaSO4?H2O),熟石膏在200℃时失水生成硫酸钙.为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A?180g置于坩埚中加热,加热过程中固体质量随温度变化记录如图:实验中每次对固体称量时须在冷却后进行.为保证实验结果的精确性,固体冷却时必须防止______.将加热到1400℃时生成的气体通入品红溶液中,品红褪色.写出1400℃时的化学反应方程式______.③固体A中生石膏的质量分数=______.
参考答案:
(1)操作a实现固体和液体分离的方法是过滤,用到的玻璃仪器有漏斗、玻璃棒、烧杯,磷酸受热容易分解,所以在结晶时应采用低温蒸发结晶,故答案为:漏斗、玻璃棒、烧杯;低温蒸发结晶;
(2)磷酸和氨气极易反应,为防止反应过于迅速会产生倒吸的危险,要采用防倒吸装置,故答案为:
(如图或其他能防止氨气倒吸的装置);
(3)能实现气、液热交换的装置是冷凝管,下口进水伤口处谁,气体和水流方向相反,故答案为:冷凝管;
(4)①对失水后的晶体进行冷却时必须防止吸水,否则会导致结果有误差,二氧化硫能使品红溶液褪色,所以加热到1400℃时,硫酸钙分解产生了二氧化硫,即
2CaSO4?1400℃?.?2CaO+2SO2↑+O2↑,设固体A中含有生石膏的质量为m,则
CaSO4?2H20?200℃?.?CaSO4+2H20? 固体质量减少量
172? 36
m? 180g-144g
172m=36180g-144g
解得:m=172g,所以固体A中生石膏的质量分数=172g180g×100%=95.6%,故答案为:95.6%.
本题解析:
本题难度:一般
5、选择题 由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下:
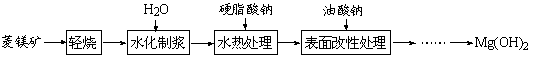
(1)从下面两图可以得出的结论为?、?。
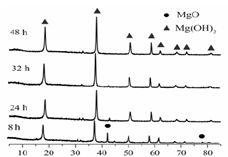 ?
?
图1 25℃时MgO水化随时间变化X射线衍射谱图?
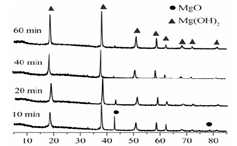
图2 90℃时MgO水化随时间变化X射线衍射谱图
(2)水化反应MgO+H2O = Mg(OH)2能自发进行的原因是?。
(3)结合元素周期律和表1可知,金属氢氧化物受热分解的规律有?。(写一条即可)
表1 ?部分主族元素的金属氢氧化物热分解温度/℃
LiOH
| NaOH
| KOH
| Al(OH)3
| Mg(OH)2
| Ca(OH)2
| Ba(OH)2
|
924
| 不分解
| 不分解
| 140
| 258
| 390
| 700
|
?
(4)已知热化学方程式:Mg(OH)2 (s) =" MgO" (s)+H2O (g)? ΔH =" 81.5" kJ·mol-1
①Mg(OH)2起阻燃作用的主要原因是?。
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是?。
参考答案:(1)随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加 ;温度升高,水化反应速率加快。
(2)ΔH < 0
(3)金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等)
(4)①Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳。②无烟、无毒、腐蚀性小
本题解析:该题工业流程作为背景设计了对图、表的解读能力及对化学反应条件、方向等方面知识的考查。(1)图1表达的是随时间的变化,MgO和Mg(OH)2的量的变化,图2给出的温度不同于图1,时间也不同于图5,由此得出结论。(2)反应的ΔS< 0,则反应ΔH < 0才有可能自发进行。(4)从燃烧的条件解释,反应吸热而使温度降低,生成耐热材料覆盖可燃物表面阻止燃烧进一步进行。有机和卤系阻燃剂会产生烟、有机磷系有毒,也会生成有毒物质。
本题难度:一般