1、选择题 已知石墨和金刚石燃烧的热化学方程式分别为:
C(石墨·s)+O2(g)===CO2(g);△H== -393.5kJ·mol-1
C(金刚石·s)+O2(g)===CO2(g);△H== -395.4kJ·mol-1
关于金刚石和石墨的相互转化,下列说法正确的是
[? ]
A.石墨转化为金刚石是自发进行的过程
B.金刚石转化成石墨是自发进行的过程
C.石墨比金刚石能量低
D.金刚石比石墨能量低
参考答案:BC
本题解析:
本题难度:一般
2、简答题 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
(1)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=______.
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强保持不变;b.混合气体中c(CO)不变;c.v正(CO)=v逆(H2);d.c(CH3OH)=c(CO)
(3)在2L的容器中加入amo1CH3OH(g)发生反应②,达到平衡后若再加入amo1CH3OH(g)重新达到平衡时,CH3OH的转化率______(填“增大”、“减小”或“不变”).
(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示.
①0~4min的平均反应速率υ(CO)=______.
②若温度不变,向该容器中加入4mo1CO、2mo1H2O、3mo1CO2(g)和3mo1H2(g),起始时D正______V逆(填“<”、“>”或“=”),请结合必要的计算说明理由______.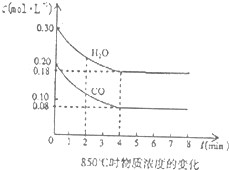
参考答案:(1)①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
依据盖斯定律①×2+②+③:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
故答案为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
(2)CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的放热反应;
a.反应前后气体体积变化,容器中压强保持不变,证明反应达到平衡,故a正确;
b.平衡状态的标志是物质浓度 保持不变,混合气体中c(CO)不变说明反应达到平衡,故b正确;
c.依据化学方程式反应达到平衡时2v正(CO)=v逆(H2)证明反应达到平衡,故C错误;
d.反应过程中c(CH3OH)=c(CO)说明剩余一氧化碳和生成甲醇浓度相同,但不能证明正逆反应速率相同,故d错误;
故答案为:ab;
(3)在2L的容器中加入amo1CH3OH(g)发生反应②,反应前后气体体积不变,达到平衡后若再加入amo1CH3OH(g)相当于增大压强,平衡不变,CH3OH的转化率不变
故答案为:不变;
(4)①图象分析平衡后一氧化碳浓度变化为0.2mol/L-0.08mol/L=0.12mol/L;V(CO)=0.12mol/L4min=0.03mol/L?min;
故答案为:0.03mol/L?min;
②若温度不变,向该容器中加入4mo1CO、2mo1H2O、3mo1CO2(g)和3mo1H2(g),Qc=0.3,mol/L×0,3mol/L0.4mol/L×0.2mol/L=98,K=0.12mol/L×0.12mol/L0.08mol/L×0.18mol/L=1
因为Qc>K,平衡左移,V正<V逆
故答案为:<;因为Qc>K,平衡左移,所以V正<V逆.
本题解析:
本题难度:一般
3、选择题 已知H2(g) +Br2(l)=2HBr(g);△H=-72kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表

则表中a为
[? ]
A.404
B.260
C.230
D.200
参考答案:D
本题解析:
本题难度:一般
4、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)?ΔH=-574?kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)?ΔH=-1160?kJ·mol-1
下列说法不正确的是
[? ]
A.?由反应①、②可推知:CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g) ΔH=-867?kJ?mol-1
B. 等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等
C.?上述反应方程式中的化学计量数既可以表示物质的量,又可以表示分子数
D.?若用标准状况下4.48?L?CH4还原NO2至N2,整个过程中转移的电子总数为1.6NA
参考答案:C
本题解析:
本题难度:一般
5、选择题 根据碘与氢气反应的热化学方程式 (i)?I2(g)+?H2(g) 2HI(g)?△H=-9.48?kJ/mol?
2HI(g)?△H=-9.48?kJ/mol?
(ii)?I2(s)+H2(g) 2HI(g)?△H=+26.48?kJ/mol 下列判断正确的是
2HI(g)?△H=+26.48?kJ/mol 下列判断正确的是
[? ]
A.254g?I2(g)中通入2gH2(g),反应放热9.48?kJ
B.1?mol固态碘与1?mol气态碘所含的能量相差17.00?kJ
C.反应(i)的产物比反应(ii)的产物稳定?
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
参考答案:D
本题解析:
本题难度:一般