| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《离子共存》高频考点预测(2020年最新版)(二)
参考答案:B 本题解析:加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该沉淀可能是氯化银沉淀,也可能是硫酸钡沉淀,故该溶液中可能有的离子,可能是SO42-,也可能是Ag+,选B。 本题难度:一般 3、选择题 浓度为0.50 mol/L的某金属阳离子Mn+的溶液10.00ml ,与0.40 mol/L的NaOH溶液12.50 ml恰好完全反应生成沉淀,则n等于 |
参考答案:A
本题解析:0.50 mol/L的某金属阳离子Mn+的溶液10.00ml的物质的量为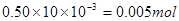 ,0.40 mol/L的NaOH溶液12.50 ml的物质的量为
,0.40 mol/L的NaOH溶液12.50 ml的物质的量为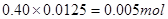 ,所以Mn+的n等于1;
,所以Mn+的n等于1;
本题难度:简单
4、选择题 某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO
参考答案:A.强碱溶液中不能大量存在HCO3-,故A错误;
B.碱溶液中该组离子之间不反应,能大量共存,故B正确;
C.碱溶液中不能大量存在NH4+、Mg2+,故C错误;
D.碱溶液中不能大量存在H+,故D错误;
故选B.
本题解析:
本题难度:简单
5、填空题 (10分)A、B、C、 D、 E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。回答下列问题:
(1)E是?溶液。?
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是??(填写序号) 。
①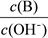 ? ②
? ②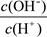 ?③c(H+)
?③c(H+)
④ OH-的物质的量?⑤ c(H+)和c(OH-)的乘积?
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,下列说法正确的是??(填写序号) 。
①反应所需要的时间E>A? ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E? ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余?⑥E溶液里有锌粉剩余
(4)室温下,将pH=1的A溶液aL与pH=12的D溶液bL混合,所得混合液的pH=3,设混合溶液体积变化忽略不计,则a:b= ?。
(5)0.1 mol·L-1C溶液中各种离子浓度由大到小的顺序是:
?。
参考答案:(1)CH3COOH(2分)
(2)①②(2分)?
(3)③④⑤(2分)
(4)1:9(2分)
(5) c(H+)>c (SO42-)> c(NH4+)>c(OH-)(2分)
本题解析:
(1)中和酸性物质A只有NaOH、NH3?H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH,由于A的PH小于E,则A为盐酸,则E为醋酸,而C与D中和后显酸性,则C为NH4HSO4;
(2)①、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,则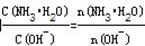 减小,故①错误;②、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则
减小,故①错误;②、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则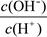
减小,故②正确;③、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;④、由NH3?H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;所以答案为:①②;
(3)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,故④正确;⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;所以答案为:③④⑤;
(4)根据PH计算:(0.1a-0.1b)/(a+b)=0.001,设a=1,则b=9
(5)由于水也电离出了氢离子,所以氢离子的量大于硫酸根离子,而铵根离子会发生水解,所以铵根离子的量小于硫酸根离子,最少的是氢氧根离子。
点评:考查电解质溶液之间的反应,涉及到强电解质、弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较等知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《分子间作用.. | |