1、选择题 下列实验方案不能达到预期目的是
A.将含有HCl的CO2气体通过饱和NaHCO3溶液
B.向X溶液中滴加盐酸酸化的BaCl2溶液
C.向醋酸钠溶液中滴入酚酞试液,加热后若红色加深
D.向含有少量苯酚的苯中加入NaOH溶液,振荡、静置、分液
参考答案:B
本题解析:分析:A、根据除杂质题最少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应时不能引进新的杂质;
B、SO42-离子的检验方法:先加稀盐酸,再加入BaCl2溶液,产生白色沉淀;
C、根据醋酸钠水解溶液呈碱性,碱能使酚酞变红,碱性越强,颜色越深,平衡正向移动,再联系平衡移动与温度的关系;
D、根据除杂质题最少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应时不能引进新的杂质.
解答:A、CO2不与饱和NaHCO3溶液发生反应;HCl气体会与饱和NaHCO3溶液发生反应,HCl气体会被除去,同时生成CO2,没有引入杂质,故A正确;
B、先加稀盐酸,可以排除银离子与碳酸根离子,再加入BaCl2溶液,产生的沉淀只能是硫酸钡,向X溶液中滴加盐酸C酸化的BaCl2溶液产生白色沉淀,可能是硫酸钡,也可能是氯化银,故B错误;
C、醋酸钠水解溶液呈碱性,碱能使酚酞变红,碱性越强,颜色越深,加热后若红色加深,说明平衡正向移动,即温度升高,平衡正向移动,即盐类的水解是吸热的,故C正确;
D、苯酚与NaOH溶液反应,生成苯酚钠和水,苯与NaOH溶液反应不反应,溶液分层,分液即可得到纯净的苯,故D正确;
故选B.
点评:本题主要考查了盐类的水解、物质的除杂,需要注意的是除杂时选择适当除杂剂和分离方法,要符合除杂的原则,就是原物质的质量不能减少,但可以增加,不能带入新的杂质,除杂剂不能和原物质反应.
本题难度:简单
2、选择题 化学反应中旧键断裂需要(?)能量
A.吸收
B.放出
C.不吸收也不放出
D.不一定
参考答案:A
本题解析:断裂化学键一定是吸收能量的,形成化学键一定放出能量。答案选A。
本题难度:一般
3、选择题 下列物质是电解质的是
A.硫酸溶液
B.酒精
C.食盐
D.铜
参考答案:C
本题解析:溶于水或熔融状态下能导电的化合物是电解质,A是混合物,D是单质,不正确。C是非电解质,所以正确的答案是C。
本题难度:简单
4、选择题 下列反应中,电子转移方向和数目正确的是( )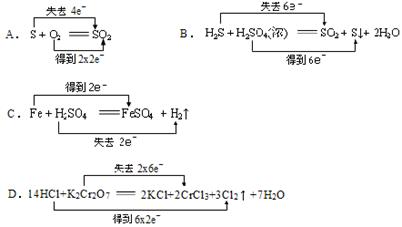
参考答案:A
本题解析:略
本题难度:一般
5、填空题 海水制取溴:
(1)主要流程:
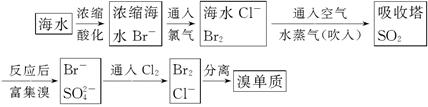
(2)主要反应(化学反应方程式):
_____________________________________。
(3)最后分离实验操作是 、
参考答案:(1)海水制取溴主要流程:利用海水制取溴:含Br-的海水通过蒸发浓缩,酸化,通入氧化剂通Cl2,氯气具有氧化性,能氧化溴离子生成单质溴;得到含溴单质的海水,通空气和水蒸气,吹出Br2蒸气,通过吸收塔用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸,产物为H2SO4、HBr溶液混合溶液,达到富集溴的目的.再通Cl2,氧化溴离子生成单质溴,利用有机溶剂CCl4萃取出碘单质;(2)Cl2+2NaBr=Br2+2NaCl;Br2+SO2+2H2O
本题解析:
本题难度:一般