| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《物质的量》试题巩固(2020年最新版)(二)
参考答案:B 本题解析:A.氦气是单原子分子,所以1 mol氦气中有NA个氦原子,错误;B.N原子相对原子质量是14,所以14 g氮气中含NA个氮原子,正确;C.2 L 0.3 mol·L-1 Na2SO4溶液中含1.2 NA个Na+ ,错误;D.18 g水的物质的量是1mol,由于水分子中含有10个电子,因此18g的水中所含的电子数为10NA,错误。 本题难度:一般 2、选择题 1 mol Na2O2与2 mol NaHCO3固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是(?) 参考答案:A 本题解析:由题可知,该过程发生的反应为:2NaHCO3 本题难度:一般 3、选择题 某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)= 参考答案:AC 本题解析:A、若KCl、Na2SO4的物质的量相同时,则电离生成的离子关系为 c(K+)=c(Cl-)= 本题难度:一般 4、选择题 某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为n(NO3-)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1, 则 M可能为 |
参考答案:B
本题解析:
由物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,根据溶液的电中性原则,则阴离子所带的负电荷总数等于阳离子所带的正电荷总数,而负电荷数为2×1+3×2>正电荷数1×3+3×1,则M为阳离子,由电荷守恒可知,M为带两个单位正电荷的阳离子,又Fe2+、NO3-、H+发生氧化还原反应,则M一定为Mg2+,答案选B。
考点:考查电荷守恒的应用
点评:本题考查了电荷守恒的应用,溶液的电中性,难度不大。需要从阴阳离子所带的电荷数上分析,由溶液的电中性为依据,还要注意Fe2+与题干中的离子不共存这一特殊性质。
本题难度:一般
5、选择题 冬季的降雪给机场和马路带来诸多不便,其中醋酸钾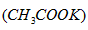 是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是
是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是
[? ]
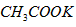 质量为98
质量为98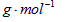
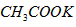 的摩尔质量等于它的相对分子质量
的摩尔质量等于它的相对分子质量 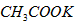 质量约为
质量约为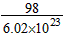 g
g 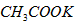 的物质的量为1 mol?
的物质的量为1 mol? 参考答案:C
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《阿伏伽德罗定律》.. | |