1、选择题 NA为阿伏加德罗常数的数值,下列说法中正确的是 (?)
A.在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应可得到NH3分子数为NA
B.一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA
C.1.0 L的0.1 mol·L-1 Na2S溶液中含有的S2-离子数为0.1NA
D.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA
参考答案:B
本题解析:A.N2与H2合成NH3的反应是可逆反应。反应不能进行到底。所以在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应得到NH3分子数小于NA。错误。B.Na是+1价金属,每摩尔的Na反应失去电子1mol。N(Na)=2.3g÷23g/mol=0.1mol,所以一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA。正确。C. n(Na2S)=1.0 L×0.1 mol/L=0.1mol.由于在溶液中S2-水解,所以 Na2S溶液中含有的S2-离子数小于0.1NA。错误。D. CCl4在标准状况下是液体,不能用气体摩尔体积来计算。错误。
本题难度:一般
2、选择题 在同温同压下20mL气体A2与40mL气体B2恰好完全反应生成40mL气体X,则气体X的化式为
A.AB2
B.AB
C.A3B
D.A2B3
参考答案:A
本题解析:同温同压,气体的体积之比等于物质的量之比,即物质的量比A2:B2:X=1:2:2;再根据化学反应过程中遵循质量守恒定律可得,X的化学式为AB2
本题难度:一般
3、填空题 取3份含0.01 mol AgNO3的溶液,分别加入NaCl、MgCl2、FeCl3溶液,恰好完全反应时需要NaCl、MgCl2、FeCl3三种物质的物质的量之比是(? )
A.1∶2∶3
B.6∶3∶2
C.3∶2∶1
D.1∶1∶1
参考答案:0.5 mol? 0.5 mol? 1.5 mol
本题解析:n(Na2CO3)= ="0.5" mol
="0.5" mol
n(C)=n(Na2CO3)="0.5" mol(C原子守恒)
n(O)=3n(Na2CO3)="3×0.5" mol="1.5" mol (O原子守恒)
本题难度:简单
4、选择题 用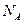 表示阿伏加德罗常数的值。下列叙述正确的是(?)
表示阿伏加德罗常数的值。下列叙述正确的是(?)
A.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为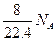
B.常温常压下,每生成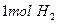 时转移的电子数为
时转移的电子数为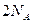
C.常温常压下,46g二氧化氮和四氧化二氮混合物中含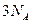 个原子
个原子
D.1mol含5个碳原子的有机物,最多形成碳碳单键数为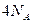
参考答案:C
本题解析:略
本题难度:简单
5、计算题 浓盐酸可以与MnO2反应制取氯气(Cl2):4HCl+MnO2==MnCl2+Cl2↑+2H2O。8.7g MnO2与足量的200mL 10 mol·L-1浓盐酸反应,可制的标准状况下的氯气多少升?假设溶液的体积没有变化,反应后剩余的溶液中Cl—的物质的量浓度是多少?
参考答案:(1)2.24L (2)9 mol·L-1
本题解析:盐酸足量所以要用MnO2的量进行计算,根据题意有:n(MnO2) =m/M=8.7g÷87g/mol=0.1mol,在根据反应方程式:
4HCl+MnO2==MnCl2+Cl2↑+2H2O。
1 1
0.1mol n(Cl2) n(Cl2) = 0.1mol V(Cl2)= 0.1mol×22.4L/mol=2.24L,
反应消耗的n(Cl—)= 0.1mol×2=0.2mol,则 剩余的n(Cl—)=0.2L×10 mol·L-1-0.2mol=1.8mol,物质的量浓度为:c=1.8mol÷0.2L=9 mol·L-1
考点:考查物质的量的有关计算。
本题难度:一般