1、选择题 下列实验能成功的是( )
①用水鉴别NaHCO3和Na2CO3固体;
②用观察法区别Na2O和Na2O2;
③用氢氧化钠溶液鉴别AlCl3和MgCl2溶液;
④用稀盐酸鉴别NaHCO3和Na2CO3溶液.
A.①②④
B.①③
C.①②③④
D.②④
参考答案:①用水鉴别NaHCO3和Na2CO3固体,相同条件下,碳酸氢钠的溶解度小,则溶解较少的为NaHCO3,能鉴别;
②用观察法区别Na2O和Na2O2,淡黄色的为Na2O2,白色的为Na2O,能鉴别;
③用氢氧化钠溶液鉴别AlCl3和MgCl2溶液,生成白色沉淀的为MgCl2,先生成沉淀后沉淀溶解的为AlCl3,能鉴别;
④用稀盐酸鉴别NaHCO3和Na2CO3溶液,反应较快的为NaHCO3,能鉴别;
故选C.
本题解析:
本题难度:一般
2、选择题 固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种.
为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;
③向Z溶液中滴加AgNO3溶液,生成白色沉淀;
④用玻璃棒蘸取溶液Z于广范pH试纸上,试纸呈蓝色.
分析以上实验现象,下列结论正确的是( )
A.X中一定不存在FeO
B.不溶物Y中一定含有Fe和CuO
C.Z溶液中一定含有KCl、K2CO3
D.Y中不一定存在MnO2
参考答案:①将X加入足量水中,得到不溶物Y和溶液Z,Y可能为Fe、FeO、CuO、MnO2中的物质,Z可能为KCl和K2CO3中的物质;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物,黄绿色气体为氯气,红色不溶物为铜,可说明Y中至少含有CuO、MnO2,并应含有Fe;
③向Z溶液中滴加AgNO3溶液,生成白色沉淀,可能为氯化银或碳酸银沉淀;
④用玻璃棒蘸取溶液Z于广范pH试纸上,试纸呈蓝色,说明溶液呈碱性,应含有K2CO3,可能含有KCl,
由以上分析可知X中应含有CuO、MnO2、K2CO3以及Fe,但不能确定是否含有FeO、KCl,
故选B.
本题解析:
本题难度:一般
3、简答题 下列是与硫元素相关的一系列实验,根据下图所示实验回答下列问题:

(1)试管C口部的棉团上发生反应的离子方程式是______
(2)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到______.试管C中溶液变浑浊,则证明SO2具有______?性.
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是______,如果浸NaHCO3溶液,则发生反应的化学方程式是______.
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是______
(5)如果反应过程中要立即停止反应,最简单的方法是______.
参考答案:(1)A中使铜与浓硫酸在加热条件下反应生成了二氧化硫气体,通过BC后,由于二氧化硫是大气污染气体,不能排放到大气中,需要进行尾气处理吸收,所以浸氢氧化钠溶液的棉花团是吸收二氧化硫的作用,反应离子方程式为SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
(2)二氧化硫通过盛品红的B试管,红色褪去,说明了二氧化硫的漂白性,二氧化硫的漂白作用是二氧化硫生成的亚硫酸与品红结合成不稳定的无色物质,加热会恢复红色;试管C中溶液变浑浊是因为发生了反应2H2S+SO2=3S↓+2H2O,反应中二氧化硫做氧化剂,故答案为:溶液由无色变成红色;氧化;
(3)试管C口部的棉团浸NaHCO3溶液,是利用碳酸氢钠溶液的碱性和酸性氧化物二氧化硫反应,吸收污染气体,防止污染大气,反应的化学方程式为NaHCO3+SO2=NaHSO3+CO2 (或2NaHCO3+SO2=Na2SO3+2CO2↑+H2O)
故答案为:吸收有害气体,防止污染空气;NaHCO3+SO2=NaHSO3+CO2 (或2NaHCO3+SO2=Na2SO3+2CO2↑+H2O);
(4)将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如Cl2、O2、O3、NO2、Cl2O等,要求填二种化合物和二种单质的化学式;故答案为:NH3 NO2 Cl2 O2;
(5)当铜丝脱离硫酸溶液时反应即可停止,可将抽动铜丝到液面上,故答案为:抽动铜丝到液面上.
本题解析:
本题难度:一般
4、实验题 (每空1分,共6分)下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下:
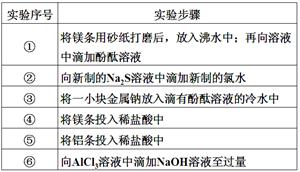
请整理并完成实验报告:
(1)实验目的:?。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。
仪器:?、酒精灯、表面皿、试管夹、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(完成下列表格中的未完成的实验现象和化学方程式):
实验序号
| 实验现象
| 化学方程式
|
①
| 有气体产生,溶液变成浅红色
| ?
|
②
| 生成浅黄色沉淀
| Na2S+Cl2=2NaCl+S↓
|
③
| ?
| 2Na+2H2O=2NaOH+H2↑
|
④
| 剧烈反应,迅速产生无色气体
| Mg+2HCl=MgCl2+H2↑
|
⑤
| 反应不十分剧烈,产生无色气体
| 2Al+6HCl=2AlCl3+3H2↑
|
⑥
| 开始时生成白色胶状沉淀,继而沉淀消失
| AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3+NaOH=NaAlO2+2H2O
|
(4)实验结论:?。
(5)请用原子结构的知识简单解释上述结论:?。
参考答案:(每空2分,共6分)
(1)实验目的:探究同周期元素性质的递变规律
(2)实验用品:仪器:试管
(3)实验内容:
实验现象:浮在水面上,熔成小球,有气体放出,做不定向移动,随之消失,溶液变成红色
化学方程式:Mg+2H2O Mg(OH) 2+2H2↑
Mg(OH) 2+2H2↑
(4)实验结论:同周期元素随原子序数的递增,失电子能力逐渐减弱,得电子能力增减增强。
(5)请用原子结构的知识简单解释上述结论::同周期元素的原子电子层数相等,核电荷数逐渐减小,原子核对核外电子的吸引能力逐渐增强,电子能力逐渐减弱,得电子能力增减增强。
本题解析:(1)根据实验步骤和原理可知,实验目的是探究同周期元素性质的递变规律。
(2)根据实验步骤可知,实验需要试管。
(3)①镁是活泼的金属,在加热的条件下能和沸水反应生成氢气和氢氧化镁,方程式为Mg+2H2O Mg(OH) 2+2H2↑。
Mg(OH) 2+2H2↑。
③钠是活泼的金属,极易和水反应生成氢气和氢氧化钠,所以实验现象是浮在水面上,熔成小球,有气体放出,做不定向移动,随之消失,溶液变成红色。
(4)根据实验现象可知,结论应该是同周期元素随原子序数的递增,失电子能力逐渐减弱,得电子能力增减增强。
(5)由于同周期元素的原子电子层数相等,核电荷数逐渐减小,原子核对核外电子的吸引能力逐渐增强,失去电子的能力逐渐减弱,得电子能力增减增强,所以金属性逐渐减弱,非金属性逐渐增强。
本题难度:一般
5、实验题 如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验

回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________;在电化学腐蚀中,负极反应是________________;正极反应是_______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_________________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
参考答案:“略”
本题解析:
本题难度:一般