|
高中化学知识点大全《化学实验的基本操作》高频考点巩固(2020年模拟版)(二)
2021-02-18 07:27:15
【 大 中 小】
|
1、选择题 实验 是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
[? ]
A.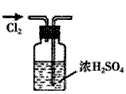
? 干燥Cl2
B.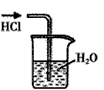
? 吸收HCl
C.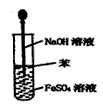
?制取Fe(OH)2沉淀
D.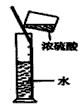
?稀释浓H2SO4
参考答案:C
本题解析:
本题难度:一般
2、填空题 实验题:(本题共9分)某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:?
A.在250 mL的容量瓶中配制250 mL烧碱溶液;
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂;?
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解;
D.将物质的量浓度为cmol/L的标准盐酸溶液装入酸式滴定管。调整液面记下开始读数为V1 mL;E.在锥形瓶下垫一张白纸,滴定最后一滴至红色刚好消失 为止,半分钟后不恢复红色,记下读数V2 mL。? 为止,半分钟后不恢复红色,记下读数V2 mL。?
| 就此实验完成下列填空:?
(1)正确操作步骤的顺序是:(用编号字母填写)??。
( 2)观察滴定管里液面的高度时应注意:?。? 2)观察滴定管里液面的高度时应注意:?。?
(3)E步骤的操作中在锥形瓶下垫一张白纸的作用是?。
(4)D步骤的操作中液面应调节到?,尖嘴部分应?。
(5)某学生实验时把锥形瓶用烧碱样品洗涤,使测定的浓度偏高还是偏低??
(6)该烧碱样品纯度的计算式为:?
参考答案:(1)正确操作步骤的顺序是:CABD(2)要平视。(3)便于明显观察。(4)调节到零刻度或零刻度以下;无气泡 (5)偏高(6) [(V2-V1)/1000]*c*2*40*10/W
本题解析:略
本题难度:简单
3、实验题 某Na2CO3样品中混有一定量的Na2SO4 (设均不含结晶水),某化学兴趣小组采用两种方案测定该样品中Na2CO3的质量分数,试回答下列问题。
方案一:利用下列方案完成Na2CO3质量分数的測定
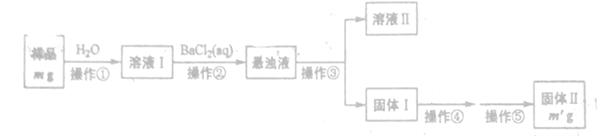
(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数:
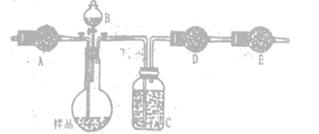
(4)填写表中空格:
仪器
| 试剂
| 加入该试剂的目的
| A
| ?
| 鼓入空气时洗去CO2
| B
| ?
| 使样品充分反应放出气体
| C
| a
| ?
| D
| e
| 充分吸收CO2
| E
| e
| ?
|
?
参考答案:(1)过滤、洗涤(2分)?(2)①③④(2分)?(3)取上层清夜再加入氯化钡溶液,如果不再产生白色沉淀,则说明操作②已经完成,反之没有完成(2分)
(4)(每空2分,共8分。仪器A、B中的试剂填试剂名称也给分)
仪器
试剂
加入该试剂的目的
A
e
?
B
d
?
C
?
除去CO2中的水蒸气
D
?
?
E
?
防止空气中的CO2、水蒸气被D中的碱石灰吸收
本题解析:(1)固体从溶液中分离出的操作是过滤,因此操作③是过滤。过滤后得到的固体需要洗涤和干燥,操作④是洗涤。
(2)溶解、过滤和洗涤均需要玻璃棒,所以操作①~④中,使用到玻璃棒的有①③④。
(3)如果操作②已经完成,则再加入氯化钡溶液会继续产生白色沉淀,所以判断操作②否完成的实验方法是取上层清夜再加入氯化钡溶液,如果不再产生白色沉淀,则说明操作②已经完成,反之没有完成。
(4)碳酸钠能和酸反应生成CO2,所以可以通过测量生成的CO2气体来测定碳酸钠的纯度。为了把装置中的CO2气体全部吸收,需要通过鼓入空气。但由于空气中也含有CO2和水蒸气,所以A装置中盛放的是碱石灰。盐酸易挥发,所以应该用稀硫酸和碳酸钠反应,即B装置中盛放的是稀硫酸。生成的CO2气体中含有水蒸气,所以需要利用能;浓硫酸来吸收CO2中的水蒸气。生成的CO2气体应该用碱石灰吸收,所以D装置中盛放的碱石灰。又因为空气中也含有CO2和水蒸气,所以E装置中也必须盛放碱石灰,以防止空气中的CO2、水蒸气被D中的碱石灰吸收。
本题难度:一般
4、实验题 (12分)为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;①称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
方法一
| 方法二
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌;
⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全;
⑥过滤、洗涤、干燥沉淀、称量得到bg固体。
| ④将25.00mL溶液置于锥形瓶中;
⑤用0.1 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。
|
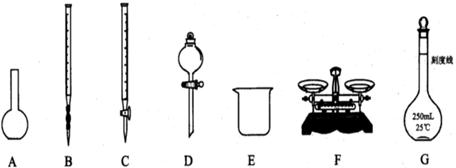
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和?(填字母);
(2)在方法一④中加入过量稀盐酸的目的是?;
(3)在方法一测定得到Na2SO3样品的纯度是?(列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂?(填“是”或“否”),请简述理由?;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果?
(填“偏高”、“偏低”、“无影响”)。
参考答案:(12分,每空2分)(1)B、F、G(全对才给分);
(2)将Na2SO3全部转化成SO2,并使溶液呈酸性,排出SO32-的干扰。
(3)? 1-142b/233a;
(4)否;KMnO4本身可作指示剂,当KMnO4溶液过量时,溶液呈紫红色;
(5)偏低。
本题解析:略
本题难度:一般
5、选择题 将下列液体分别与溴水混合并振荡,静置后分为两层,两层几乎均呈无色的是?
A?氯水? B?己烯? C?苯? D?碘化钾溶液
参考答案:B
本题解析:略
本题难度:简单
|  2)观察滴定管里液面的高度时应注意:?。?
2)观察滴定管里液面的高度时应注意:?。?