1、实验题 (8分)下图是我校实验室化学试剂浓硫酸标签上的部分内容。
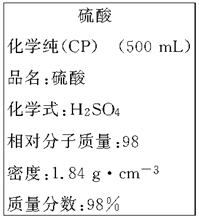
现需要480 mL 1 mol·L-1的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用的仪器有:
①胶头滴管;②玻璃棒;③烧杯;④量筒。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有_________________(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因是________。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
参考答案:(1)500 mL的容量瓶 ;(2)27.2 ; > ;(3)①③⑤
本题解析::(1)配制顺序是:计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用量筒(用到胶头滴管)量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:量筒、胶头滴管、烧杯、玻璃棒、100mL容量瓶,故答案为:100 mL的容量瓶、玻璃棒; (2)如图所示浓硫酸的浓度为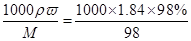 =18.4mol/L.稀释前后溶质的物质的量不发生变化,故18.4mol/LxV=480mlx1mol/L,解得V=27.2ml;若将该浓硫酸与等体积的水混合,硫酸溶质的质量不发生变化,质量分数为
=18.4mol/L.稀释前后溶质的物质的量不发生变化,故18.4mol/LxV=480mlx1mol/L,解得V=27.2ml;若将该浓硫酸与等体积的水混合,硫酸溶质的质量不发生变化,质量分数为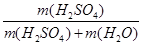 ,由于硫酸的密度大于水的密度,等体积混合硫酸的质量大于水的质量,故质量分数大于49%;(3)根据c=n/V可知,①用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则溶质增加,浓度偏高;②容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,不影响实验结果;③用蒸馏水洗涤量筒,并转移到烧杯中,会使溶质的物质的量偏大,浓度偏高;④转移溶液时,不慎有少量溶液洒到容量瓶外面,则溶质减少,浓度偏小;⑤定容时,俯视容量瓶刻度线进行定容,则容量瓶中溶液体积减少,浓度偏高;⑥定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,则容量瓶中溶液体积增加,浓度偏小,故答案为①③⑤.
,由于硫酸的密度大于水的密度,等体积混合硫酸的质量大于水的质量,故质量分数大于49%;(3)根据c=n/V可知,①用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则溶质增加,浓度偏高;②容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,不影响实验结果;③用蒸馏水洗涤量筒,并转移到烧杯中,会使溶质的物质的量偏大,浓度偏高;④转移溶液时,不慎有少量溶液洒到容量瓶外面,则溶质减少,浓度偏小;⑤定容时,俯视容量瓶刻度线进行定容,则容量瓶中溶液体积减少,浓度偏高;⑥定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,则容量瓶中溶液体积增加,浓度偏小,故答案为①③⑤.
考点:一定物质的量浓度溶液的配制
本题难度:一般
2、选择题 下列反应中,反应物的用量或浓度改变时,不会改变生成物的是(?)
A.铁与硫酸反应
B.氢氧化钠溶液和CO2反应
C.硫在氧气中燃烧
D.铜和与硝酸反应
参考答案:C
本题解析:略
本题难度:一般
3、选择题 100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为
[? ]
A.0.20mol/L
B.0.25mol/L
C.0.4mol/L
D.0.5mol/L
参考答案:C
本题解析:
本题难度:简单
4、计算题 30.将50mL 0.5mol/L Na2CO3溶液加水 稀释到250mL,所得溶液中Na+的物质的量浓度为___________mol.L-1.
参考答案:0.2
本题解析:因为在稀释过程中,溶质的质量是不变的。所以稀释后的碳酸钠的浓度为 。碳酸钠在溶液中的电离方程式为Na2CO3=2Na++CO32-,所以溶液中钠离子的浓度为0.1mol/L×2=0.2mol/L。
。碳酸钠在溶液中的电离方程式为Na2CO3=2Na++CO32-,所以溶液中钠离子的浓度为0.1mol/L×2=0.2mol/L。
本题难度:一般
5、选择题 0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
A.5:2
B.3:1
C.15:2
D.1:3
参考答案:C
本题解析:根据化学式可知,两种溶液中氯离子的物质的量分别是0.5L ×1mol/L×3=1.5mol、0.2L×1mol/L×1=0.2mol,所以溶液中二者的Cl-的数目之比15︰2,答案选C。
本题难度:一般