1、填空题 某工厂废液经测定得知主要含有乙醇,其中还含有丙酮、乙酸和乙酸乙酯。根据下表中各物质的性质,按下列步骤回收乙醇和乙酸。已知:乙酸乙酯在碱性条件下水解生成乙酸钠和乙醇。
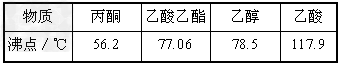
①向废液中加入烧碱溶液,调整溶液的pH=10;
②将混合液放入蒸馏器中缓缓加热;
③收集温度在70~85℃时的馏出物;
④排出蒸馏器中的残液,冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,回收馏出物。
请回答下列问题:
(1)加入烧碱使溶液的pH=10的目的是________________。
(2)在70~85℃时馏出物的主要成分是________________。
(3)在步骤④中加入过量浓硫酸的目的是(用化学方程式表示)_____________________。
参考答案:(1)将乙酸转化为乙酸钠,使乙酸乙酯在加热时转化为乙酸钠和乙醇
(2)乙醇?
(3)2CH3COONa+H2SO4→Na2SO4+2CH3COOH
本题解析:
本题难度:一般
2、选择题 下列净化水操作中,净化程度最高的是 (?)
A.静置
B.吸附
C.过滤
D.蒸馏
参考答案:D
本题解析:净化程度最高的是蒸馏,因为杂质离子沸点很高,不可能变成气体,只有水才变为水蒸气,得到的蒸馏水纯度最高。
本题难度:简单
3、选择题 下列混合物,可用分液漏斗来分离的是
A.酒精和水
B.碘和四氯化碳
C.水和四氯化碳
D.汽油和植物油
参考答案:C
本题解析:略
本题难度:简单
4、填空题 ( 7分 )某学生设计了如下实验:

回答下列问题:
(1)该同学的实验目的是?
(2)上图括号内的操作步骤均为:??,所需的两种玻璃仪器是:?、
?
(3)按此实验方案得到的NaCl固体中肯定含有?(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的?;
(4)写出生成B的化学方程式:?
参考答案:(每空1分)(1)分离CaCl2和NaCl? (2)加热蒸发?玻璃棒?酒精灯
(3)Na2CO3?盐酸(HCl)?(4)CaCl2+Na2CO3=CaCO3↓+2NaCl
本题解析:(1)根据流程图可知,该同学的实验目的是分离CaCl2和NaCl 。
(2)氯化钠和氯化钙都是易溶的,因此要得到晶体都需要加热蒸发,需要的玻璃仪器是玻璃棒、酒精灯。
(3)由于Na2CO3是过量的,所以氯化钠中含有的杂质是Na2CO3,因此需要在滤液中加入盐酸酸化。
(4)B是碳酸钙,反应的方程式是CaCl2+Na2CO3=CaCO3↓+2NaCl。
本题难度:一般
5、选择题 如果你家里的食用油混有水份,你将采用何种方法分离(? )
A过滤? ?B蒸馏
?B蒸馏
C分液? D萃取
参考答案:C
本题解析:略
本题难度:简单