1、填空题 某兴趣小组用下图装置探究氨的催化氧化
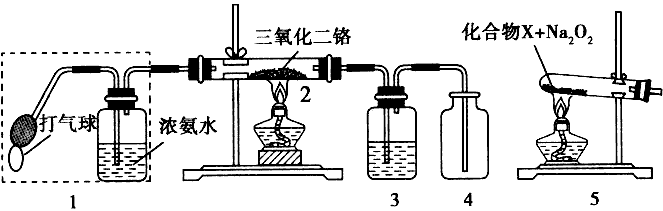
(1)氨催化氧化的化学方程式为________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是____反应(填“吸热”或“放 热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入_____;若取消3,在4 中仅观察到大量白烟,原因是___________________。
(4)为实现氨催化氧化,也可用装置5替换装置____(填装置代号);化台物X 为____(只写一种),Na2O2的作用是____。
参考答案:(1)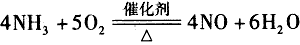
(2)放热
(3)浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
(4)1;NH4Cl;与HCl反应生成氧气
本题解析:
本题难度:一般
2、选择题 化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是( )
A.检验C2H5Cl中Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化
B.鉴别溶液中是否含有Br-时,所加的AgNO3溶液用硝酸酸化
C.鉴定待测溶液中是否含有Fe2+时,用硝酸酸化
D.为提高KMnO4溶液的氧化能力,用盐酸将KMn04溶液酸化
参考答案:A.检验Cl元素时,在碱性条件下水解生成Cl-,常用AgNO3溶液检验,但不能用硫酸酸化,否则生成硫酸银沉淀,干扰试验现象,应用硝酸酸化,故A错误;
B.鉴别溶液中是否含有Br-时,所加的AgNO3溶液用硝酸酸化,生成的AgBr不溶于硝酸,故B正确;
C.硝酸与Fe2+发生氧化还原反应,不能用硝酸酸化,应用非氧化性酸酸化,故C错误;
D.盐酸与KMnO4发生氧化还原反应,导致KMn04变质,酸化时,应用硫酸,故D错误,
故选B.
本题解析:
本题难度:简单
3、实验题 (16分)溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20 mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是?(填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是?。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测。请填空:
?
| 操作
| 预期现象及结论
|
方案1
| 取少量黄色溶液,加入NaOH溶液
| 如果生成红褐色沉淀,则说明发生了反应
|
方案2
| 取少量黄色溶液,加入淀粉碘化钾溶液
| 如果溶液变蓝色,则说明未发生反应
|
方案3
| 取少量黄色溶液,加入四氯化碳,振荡
| 如果下层溶液呈橙红色,则说明:
?
|
①方案1是否合理??(填“合理”或“不合理”)。
方案2中,由于存在反应?(用离子方程式表示),所以预测结论不正确。
②请你另外设计一个合理方案,证明已经反应。将有关内容填入下表。
实验操作
| 预期现象及结论
| 解释现象的离子方程式
|
?
| ?
| ?
参考答案:(16分)
(1)①Fe3+?(2分)?②Br2?(2分)
(2)未发生反应(2分)
①不合理?(2分)? 2 Fe3+ + 2 I-="=" 2 Fe2+?+ I2?(2分)
②(6分)
实验操作
预期现象及结论
解释现象的离子方程式
取少量黄色溶液,
滴加KSCN溶液
溶液变为红色,则说明发生了反应
Fe3++ 3SCN-=Fe(SCN)3
本题解析:略
本题难度:一般
4、填空题 (19分)实验室里有一瓶KCl与CaCl2的固体混合物,通过下面实验可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl,根据实验步骤填写下列空白:

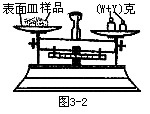 ?(1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。 ?(1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。
(2)滤液中加入的B物质是_______,应该加
入过量B物质,理由是_____。
(3)过滤得到沉淀C时,为检验沉淀是否洗净,
应用蒸馏水多次洗涤后,在最后几滴滤出
液中加入______,若______,表示沉淀已洗净。
(4)配制100mL0.20mol·L-1的KCl溶液:某学生用托盘天平将准确称取的(A)1.500gKCl固体放入烧杯中,加入(B)约30mL蒸馏水,用玻璃棒搅拌使其溶解,冷却到室温后,(C)将KCl溶液由烧杯小心倒入100mL容量瓶(不漏液)中,(D)然后往容量瓶中加蒸馏水,直到液面接近标线1—2cm处,摇匀并静置几分钟后,改用胶头滴管加蒸馏水,(E)使溶液凹面最低点恰好与刻度相切,把容量瓶盖盖好,振荡摇匀后装瓶。该学生操作中错误的是_____(填写编号)。
(5)下面哪些操作会导致所配的100mL0.20mol·L-1的KCl溶液浓度降低_________。
(A)容量瓶用蒸馏水洗涤三次直到洗净
(B)称量KCl固体时将砝码放在左盘
(C)未洗涤转移KCl溶液的烧杯
(D)转移KCl溶液时有KCl溶液溅出
(E)定容时仰视刻度线
参考答案:(1)继续慢慢加入样品至天平指针指在标尺中间,称样完毕;
(2)盐酸,可使未反应的K2CO3完全转化为KCl?;
(3)AgNO3溶液,无沉淀;
(4)托盘天平无法称量出1.500gKCl;转移KCl溶液应该用玻璃棒小心引流入100mL容量瓶中;未洗涤烧杯2-3次。故答案是:ACD;
(5)BCDE
本题解析:分析:本题是综合考查托盘天平的使用,过滤洗涤及物质的量浓度溶液的配制的基本操作技能。(1)称量样品时,放好样品和砝码后,若指钍偏向右边时,说明此时右盘重,下面的操作应该继续慢慢加入样品至天平指针指在标尺中间,称样完毕。(2)滤液中入的B物质是盐酸,盐酸过量可使未反应的K2CO3完全转化为KCl反应如 下:K2CO3+2HCl=2KCl+2H2O+CO2↑(3)为检验沉淀是否洗净,应在最后的几滴洗出液中加入AgNO3溶液,若已将CaCO3沉淀洗涤净,洗出液中不再会含有Cl-,加入AgNO3溶液无沉淀生成,反之会有AgCl沉淀生成。(4)有三处错误:一是注意有效数值;二是烧杯中的溶液不能直接倒入容量瓶,而是沿玻璃棒倒入容量瓶;三是应该洗涤玻璃棒及烧杯2-3次,把洗涤转入容量瓶中。(5)配一定物质的量浓度的溶液时,很多操作可能会导致所配的溶液的深度偏高或偏低或不变,要注意用C=n/V进行判断。
本题难度:一般
5、实验题 (10分)实验室中用浓盐酸与MnO2制取Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高易发生副反应:
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通过):

(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率? b.容易控制反应速率? c.有副反应发生?
d.可防止副反应发生? e.容易污染环境? f.可防止污染环境
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右的方向)为?;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因?
?。
(3)如果反应前加入了m g Ca(OH)2,反应结束并冷却后倒出固体物质称量为n g(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简):?。
参考答案:(1)
?
优点
缺点
甲装置
d
ae
乙装置
f
ac
丙装置
b
ce
本题解析:略
本题难度:简单
|