1、选择题 在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:

根据以上数据,下列叙述正确的是(? )
A.在上述条件下反应生成1 mol SO3固体放热Q/2 kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
参考答案:D
本题解析:2SO2(g)+O2(g) 2SO3(g)? ΔH="-Q" kJ·mol-1表示2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出Q kJ的热量。由于SO3(g)变成SO3(s)要放出热量,所以在上述条件下反应生成1 mol SO3固体放热大于Q/2 kJ;甲容器中物质不可能完全反应,所以Q1<Q;乙容器中物质不可能完全反应,且相对于甲容器,相当于达平衡后再将甲容器体积扩大为原来的2倍,平衡逆向移动,又吸收部分热量,所以2Q2<Q1;丙容器中物质不可能完全反应且与乙容器中物质的转化率相同,所以Q2=Q3。故有2Q2=2Q3<Q1<Q
2SO3(g)? ΔH="-Q" kJ·mol-1表示2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出Q kJ的热量。由于SO3(g)变成SO3(s)要放出热量,所以在上述条件下反应生成1 mol SO3固体放热大于Q/2 kJ;甲容器中物质不可能完全反应,所以Q1<Q;乙容器中物质不可能完全反应,且相对于甲容器,相当于达平衡后再将甲容器体积扩大为原来的2倍,平衡逆向移动,又吸收部分热量,所以2Q2<Q1;丙容器中物质不可能完全反应且与乙容器中物质的转化率相同,所以Q2=Q3。故有2Q2=2Q3<Q1<Q
本题难度:一般
2、填空题 I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
时间/s
| 0
| 1
| 2
| ?3
| 4
| 5
|
c(NO)/mol·L-1
| 1.00×10-3
| 4.50× 10-4
| 2.50×10-4
| 1.50×10-4
| 1.00×10-4
| 1.00×10-4
|
c(CO)/mol·L-1
| 3.60×10-3
| 3.05×10-3
| 2.85×10-3
| 2.75×10-3
| 2.70×10-3
| 2.70×10-3
|
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的ΔH?0(填“>”、“<”或“=”)。
(2)前2s内的平均反应速度v (N2)=?。
(3)该温度下,反应的平衡常数K=?。
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如下图一所示。
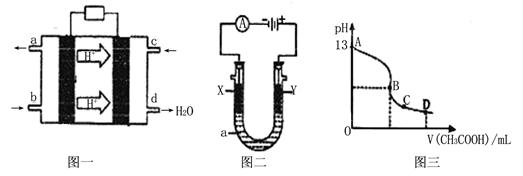
(1)该电池正极的电极反应式为?。
(2)以上述电池为电源,构成图二电解池 ,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式?。
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸 )? ?。
参考答案:(共12分,每空2分)
I?(1)<?(2)1.875×10-4 mol·L-1·S-1?或1.9×10-4 mol·L-1·S-1?等等(3)5000
II(1)O2+ 4H+ + 4e- =? 2H2O
(2)2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(3)c(CH3COO-)> c(K+) > c(H+)> c(OH-)
本题解析:I(1)因该反应2NO+2CO 2CO2+N2中气体减少,则△S<0非自发,
2CO2+N2中气体减少,则△S<0非自发,
由反应能够自发进行,则△H-T△S<0,即该反应一定是放热才有可能自发进行,
放热反应的△H<0,故答案为:<;
(2)由化学反应速率之比等于化学计量数之比,则
υ(N2)=1/2υ(NO)≈1.88×10-4mol?L-1?s-1,故答案为:1.88×10-4mol?L-1?s-1;
(3)由表格中的数据可知到4s时达到化学平衡,则
2NO+2CO 2CO2+N2
2CO2+N2
开始1.00×10-33.60×10-3 0 0
转化9×10-49×10-49×10-4 4.50×10-4
平衡1.00×10-4 2.70×10-3 9×10-44.50×10-4
则K=[(9×10-4)2?(4.5×10-4)]/[ (1×10-4)2?(2.7×10-3)2] =5000,故答案为:5000;
II、(1)正极充入的是O2,得到电子,电极式为O2+ 4H+ + 4e- =? 2H2O。
(2)电解KCl溶液的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(3) ““(2)”电解一段时间后的溶液为碱性,滴入醋酸溶液后酸性增强,C点的各离子浓度的大小关系为c(CH3COO-)> c(K+) > c(H+)> c(OH-)。
点评:本题综合考查反应速率、反应方向、化学平衡、电解原理等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,是较好的一道综合题。
本题难度:一般
3、填空题 (7分)在一个固定体积的密闭容器中加入2 mol A和1 mol B,发生如下反应:
2A(g)+B(g) 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为w mol·L-1。若维持容器体积和温度不变,用下列物质作为起始物质时,经反应达平衡后C的浓度(填“大于”“小于”或“等于”):
(1)加入1 mol A和1 mol B时,C的平衡浓度___________________________w mol·L-1。
(2)加入2 mol A和1 mol B,3 mol C和1 mol D时,C的平衡浓度___________w mol·L-1。
(3)加入3 mol C和1 mol D时,C的平衡浓度_____________________________w mol·L-1。
(4)加入2 mol B、3 mol C、1 mol D时,C的平衡浓度_____________________w mol·L-1。
参考答案:(1)小于?(2)大于?(3)等于(4)大于
本题解析:(1)相当于在原平衡的基础上减少1 mol A,化学平衡向逆反应方向移动,故C的浓度减小;(2)据等效平衡原理,等效于原起始反应物的2倍,相当于增大压强,平衡向逆反应方向移动,但C的浓度增大;(3)等效于原起始浓度,C的浓度不变;(4)等效于向原平衡中加入2 mol B,平衡向正反应方向移动,C的浓度增大。
本题难度:一般
4、选择题 在2CH4+2NH3+3O2=2HCN+6H2O反应中,同一时间内测得v(O2)为b?mol·L-1·min-1?,v(HCN)为a?mol·L-1·min-1?,则a与b的关系为
A.b =1/2 a
B.b =2/3 a
C.b =3/2 a
D.b =2 a
参考答案:C
本题解析:正确答案:C速率之比等于方程式的计量数之比,a与b之比为2:3,C正确。
本题难度:困难
5、选择题 一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是
[? ]
A.c1:c2的值不能确定
B.平衡时,Y和Z的生成速率之比为3:2
C.0.28mol·L-1<c1+c2+c3<0.56mol·L-1?
D.c1的取值范围为0<c1<0.14 mol·L-1
参考答案:A
本题解析:
本题难度:一般