1、简答题 碳酸锶广泛应用于电子工业.以天青石(主要成分为SrSO4)为基本原料制备碳酸锶.
(1)碳还原法制备.
①已知:SrSO4(s)+4C(s)
4CO(g)+SrS(s);△H=+akJ-mol-1
SrSO4(s)+2C(s)2CO2(g)+SrS(s);△H=+bkJ-mol-1
则反应C(s)+CO2(g)2CO(g)的△H=______kJ-mol-1.
②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为______.
③水解所得Sr(OH)2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为______.
(2)湿法制备.(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为______.
②当转化完成时,混合液中c(C)=1.0×10-3mol/L,c(S)=______mol/L.
参考答案:(1)①由Ⅰ:SrSO4(s)+4C(s)高温
本题解析:
本题难度:一般
2、填空题 已知下列三个热化学方程式
①H2(g)+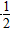 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1
写出表示碳燃烧生成CO和CO燃烧生成CO2的燃烧热的热化学方程式。 _________________________________________; _________________________________________。
参考答案:C(s)+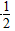 O2(g)===CO(g) ΔH=-110.8 kJ·mol-1
O2(g)===CO(g) ΔH=-110.8 kJ·mol-1
CO (g)+ O2(g)===CO2(g) ΔH=-282.7 kJ·mol-1
O2(g)===CO2(g) ΔH=-282.7 kJ·mol-1
本题解析:
本题难度:一般
3、选择题 1840年,俄国化学家盖斯从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知7.2g碳在12.8g的氧气中燃烧,至反应物耗尽,放出x kJ热量。已知单质碳的燃烧热为y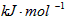 则1mol C与反应生成CO的反应热△H为
则1mol C与反应生成CO的反应热△H为
[? ]
A.-y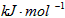
B.-(10x-y)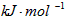
C.-(5x-0.5y)
D.-(2.5x-0.5y)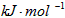
参考答案:D
本题解析:
本题难度:一般
4、简答题 过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途.
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源.负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图1所示.该电池放电时正极的电极反应式为:______;以MnO2做正极材料,可能是因为______.
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1H2O2(l)=H2O(l)+1/2O2(g)△H=-98.64kJ?mol-1
H2O(l)=H2O(g)△H=+44kJ?mol-1反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)?的△H=______.
(3)O3可由臭氧发生器(原理如图2所示)电解稀硫酸制得.
①图中阴极为______(填“A”或“B”).
②若C处通入O2,则A极的电极反应式为:______.
③若C处不通入O2,D、E处分别收集到11.2L和有4.48L气体(标准状况下),则E处收集的气体中O3所占的体积分数为______
(忽略O3的分解).
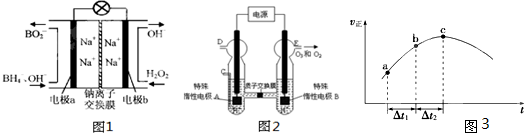
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx?95%以上是以NO形式存在的,可发生反应NO(g)+O3?(g)
NO2(g)+O2(g).在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图(如图3)所示.由图可得出的正确说法是______
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.△t1=△t2时,NO的转化率:a~b段小于b~c段.
参考答案:(1)原电池负极发生氧化反应,正极反应还原反应,由原电池工作原理图1可知,电极a为负极,电极b为正极,H2O2在正极放电生成OH-,电极反应式为H2O2+2e-=2OH-;?MnO2对电极反应具有催化作用.
故答案为:H2O2+2e-=2OH-;MnO2对电极反应具有催化作用.
(2)已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1
②H2O2(l)=H2O(l)+1/2O2(g)△H=-98.64kJ?mol-1
③H2O(l)=H2O(g)△H=+44kJ?mol-1
由盖斯定律,①+②×2+③×3得N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-534kJ?mol-1+2×(-98.64kJ?mol-1)+2×44kJ?mol-1=-643.28kJ?mol-1
故答案为:-643.28kJ?mol-1.
(3)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极.
故答案为:A.
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O.
故答案为:O2+4H++4e-=2H2O.
③若C处不通入O2,实质为电解水,D处为氢气,物质的量为11.2L22.4L/mol=0.5mol,E处为氧气、臭氧,物质的量共为4.48L22.4L/mol=0.2mol,令臭氧的物质的量为xmol,根据电子转移守恒有0.5mol×2=xmol×3×2+(0.2mol-xmol)×2×2,解得x=0.1,所以E处收集的气体中O3所占的体积分数为0.1mol0.2mol×100%=50%.
故答案为:50%.
(4)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡.
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,C点未达到平衡状态,故a错误;
b.反应为达平衡,b点在c点之前,浓度反应物浓度:b点大于c点,故b错误;
c.该反应为放热反应,反应物的总能量高于生成物的总能量,故c错误;
d.a~b段反应速率小于b~c段反应速率,△t1=△t2时,b~c段反应的NO更多,故NO的转化率:a~b段小于b~c段,故d正确.
故选:d.
本题解析:
本题难度:一般
5、选择题 S(单斜)和S(正交)是硫元素的两种单质.
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ?mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ?mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
A.△H3=-0.33?kJ?mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.正交硫比单斜硫稳定
D.单斜硫比正交硫稳定
参考答案:AC
本题解析:
本题难度:简单