|
高考化学知识点归纳《无机非金属材料》高频试题预测(2020年最新版)(二)
2021-06-11 05:45:46
【 大 中 小】
|
1、选择题 能源家族成员:①石油 ②电力 ③风能 ④天然气 ⑤水煤气 ⑥氢能, 其中属于二次能源的有
A.①③⑥
B.②④⑤
C.①③④
D.②⑤⑥
参考答案:D
本题解析:(1)一次能源是指直接取自自然界没有经过加工转换的各种能量和资源,它包括:原煤、原油、天然气、核能、太阳能、水力、风力、波浪能、潮汐能、地热、生物质能和海洋温差能等等;(2)由一次能源经过加工转换以后得到的能源产品,称为二次能源,例如:电力、蒸汽、煤气、汽油、柴油、重油、液化石油气、酒精、沼气、氢气和焦炭等等,因此答案选D。
本题难度:一般
2、填空题 (10分)(1)写出下列工业生产过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________________
②电解法冶炼铝______________________________________________________
③湿法炼铜______________________________________________________
(2)海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下步骤:
①把贝壳制成石灰乳?
②直接往海水中加石灰乳,沉降、过滤、洗涤沉淀物?
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解。
下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解制镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
| 步骤②不够合理,理由是?
??。
参考答案:(1)① Fe2O3 + 2Al??高温??2Fe + Al2O3
② 2Al2O3(熔融)电解??4Al + 3O2↑
③ CuSO4+Fe=FeSO4+Cu?(2)D;
海水中镁离子浓度小,沉淀剂的用量大,不经济。应利用晒盐后的苦卤水或利用太阳能蒸发浓缩后,再加入沉淀剂。
本题解析:(1)考查常见化学方程式的书写。
(2)选项D不正确,在反应过程中还有复分解反应,答案选D。由于海水中镁离子浓度小,沉淀剂的用量大,不经济。正确的方法应是利用晒盐后的苦卤水或利用太阳能蒸发浓缩后,再加入沉淀剂。
本题难度:一般
3、填空题 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
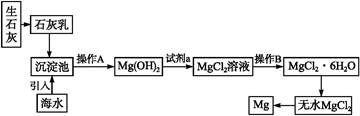
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池中发生反应的离子方程式 。?
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。?
(3)操作A是 ,操作B是 。?
(4)加入的足量试剂a是 (填化学式)。?
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。?
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_____________________________________________
参考答案:(1)沉淀Mg2+[或使Mg2+形成Mg(OH)2沉淀](1分)
Mg2++2OH- Mg(OH)2↓(1分) Mg(OH)2↓(1分)
(2)贝壳(或牡蛎壳等)(1分)
(3)过滤 蒸发结晶(或加热浓缩)(每空0.5分)
(4)盐酸(1分)
(5)MgCl2(熔融)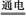 Mg+Cl2↑(2分) 制盐酸,循环使用(1分) Mg+Cl2↑(2分) 制盐酸,循环使用(1分)
(6)海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度增大且成本低(2分)
本题解析:(1)由框图我们可以看出加入石灰乳后生成了Mg(OH)2,很明显作用就是为了将Mg2+沉淀;(2)CaCO3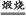 CaO+CO2↑,海洋中贝壳含有丰富的CaCO3;(3)由框图可知操作A是过滤,操作B是蒸发结晶;(4)从框图中可以看出由Mg(OH)2到MgCl2需加盐酸;(5)电解生成的Cl2可与H2反应生成HCl,循环使用。(6)海水中尽管含镁丰富,但浓度较小,之所以将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁就是为了把镁富集,且成本比较低。 CaO+CO2↑,海洋中贝壳含有丰富的CaCO3;(3)由框图可知操作A是过滤,操作B是蒸发结晶;(4)从框图中可以看出由Mg(OH)2到MgCl2需加盐酸;(5)电解生成的Cl2可与H2反应生成HCl,循环使用。(6)海水中尽管含镁丰富,但浓度较小,之所以将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁就是为了把镁富集,且成本比较低。
本题难度:一般
4、填空题 下图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题。
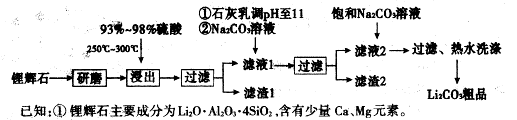
②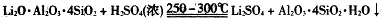
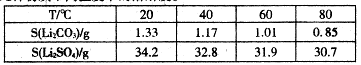
③几种物质不同温度下的溶解度。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是?。
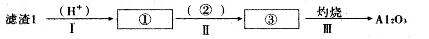
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:
?。
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是?。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是?。
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是?。
参考答案:(1)①铝盐(或Al3+)②氨水(或适量氢氧化钠溶液)
Al3++3NH3·H2O=Al(OH)3↓+3NH4+或Al3++3OH-=Al(OH)3↓
(2)Mg2++2OH-=Mg(OH)2↓? Ca2++CO32-=CaCO3↓
(3)Li2CO3溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。
(4)①2Cl--2e-=Cl2
②2LiOH+NH4HCO3=Li2CO3+(NH4)2CO3+2H2O
本题解析:(1)根据过称图,③灼烧得到Al2O3,②应为Al(OH)3,则①溶液中应该含有Al3+。一般制备Al(OH)3是用可溶性铝盐与氨水反应。所以,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(2)生成滤渣2,是由于加入了石灰乳和Na2CO3,故离子方程式为Mg2++2OH-=Mg(OH)2↓? Ca2++CO32-=CaCO3↓
(3)由题中表格可知,Li2CO3溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。
(4)①根据题叙述“将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解”,阳极发生氧化反应,2Cl--2e-=Cl2
②根据题意可知反应方程式2LiOH+NH4HCO3=Li2CO3+(NH4)2CO3+2H2O
本题难度:困难
5、选择题 下列说法正确的是
[? ]
A.由于水泥是一种固体粉末,随便找一个东西盛起来就可以储存
B.建筑三峡大坝要用到1. 082×107 t的水泥,为节约开支,购买价格低廉的水泥
C.只要是水泥就可以用来建大厦
D.在具体的建筑中,所用水泥的强度等级要符合
参考答案:D
本题解析:
本题难度:简单
|