1、实验题 (8分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
实验1:如图所示连接装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始30 s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
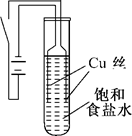
实验2:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
序号
| 操作
| 现象
|
①
| 滴入稀硝酸溶液
| 沉淀溶解,有无色气泡产生,最终得到蓝色溶液
|
②
| 滴入稀硫酸溶液
| 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色
|
阅读资料:常见铜的化合物颜色如下:
物质
| 颜色
| 物质
| 颜色
|
氯化铜
| 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色
| 氢氧化亚铜(不稳定)
| 橙黄色
|
碱式氯化铜
| 绿色
| 氢氧化铜
| 蓝色
|
氧化亚铜
| 砖红色或橙黄色
| 氯化亚铜
| 白色
|
请回答下列问题:
(1)铜的常见正化合价为________、________,最终试管底部橙黄色沉淀的化学式________________.
(2)阴极上发生的反应为________________;阳极上发生的反应为________________.
(3)写出实验2中①、②的离子方程式:
①____________________________________,②______________________________.
参考答案:(1)+1 +2 Cu2O?(2)2H++2e-===H2↑
Cu+Cl--e-===CuCl↓(或Cu+OH--e-===CuOH↓)
(3)①3Cu2O+14H++2NO===6Cu2++2NO↑+7H2O
②Cu2O+2H+===Cu+Cu2++H2O
本题解析:(1)铜有+1价和+2价,据实验1的现象说明橙黄色沉淀较稳定,再结合铜的化合物的颜色知该物质应为Cu2O,而Cu2O也符合实验2中的要求。
(2)在阴极上H+放电,反应为2H++2e-===H2↑,而阳极为铜,据现象及信息知反应为Cu-e-+Cl-===CuCl↓。
(3)Cu2O与稀HNO3发生了氧化还原反应,方程式为
3Cu2O+14H++2NO===6Cu2++2NO↑+7H2O,Cu2O与H2SO4反应,据反应现象知产物有CuSO4与Cu生成,故反应为Cu2O+2H+===Cu+Cu2++H2O。
本题难度:一般
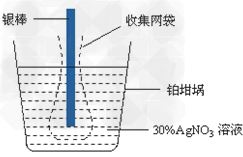
2、选择题 已知电极上每通过96500?C的电量就会有1?mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是?
[? ]
A.电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag+?+?e-?=?Ag?
B.称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0?mg,则电解过程中通过电解池的电量为96.5?C?
C.实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D.若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
参考答案:D
本题解析:
本题难度:一般
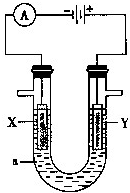
3、简答题 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为______,在X极附近观察到的现象是______.
电解液中向X极方向移动的离子是______.
②Y电极上的电极反应式为______.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是______.
②Y电极的电极反应式为______.(说明:杂质发生的反应不必写出)
③溶液中的c(Cu2+)与电解前相比______(填“变大”、“变小”或“不变”).
参考答案:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
故答案为:2H++2e-=H2↑或2H2O+2e-=H2+2OH-;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:精铜;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
③粗铜做阳极,其中的杂质锌、镍等也会失电子,所以依据电子守恒,阴极析出的铜比阳极溶解的铜多,溶液中铜离子浓度减小,故答案为:变小.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移
B.含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022
C.28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022