1、选择题 同温同压下,等质量的CO和CO2相比较,下列叙述中正确的是( )
A.体积比为1:1
B.体积比为11:7
C.原子数比为2:3
D.密度比为11:7
参考答案:CO和CO2等质量则物质的量之比为:m28:m44=11:7,同温同压下体积比=物质的量比=11:7,故A错误,B正确,
CO和CO2中的原子个数比=11×27×3=22:21,故C错误,
同温同压下,气体密度之比等于摩尔质量的之比,即为28:44=7:11,故D错误.
故选B.
本题解析:
本题难度:一般
2、填空题 (8分)(1)2 molO3与3 molO2的质量之比_______,分子数之比_______,同温同压下的密度之比_____,含氧原子数之比_______,体积之比_______.
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与________L Cl2的消毒能力相当.
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为_______________________
参考答案:(1)1∶1 2∶3 3∶2 1∶1 2∶3
(2)30 (3)O3F2 阿伏加德罗定律和质量守恒定律
本题解析:(1)由m=nM知,两气体的质量比为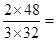 1:1;分子数之比等于物质的量之比:2∶3;同温同压下密度比等于式量比:3:2;均含有6mol氧原子;体积比等于物质的量比:2:3
1:1;分子数之比等于物质的量之比:2∶3;同温同压下密度比等于式量比:3:2;均含有6mol氧原子;体积比等于物质的量比:2:3
(2)由化合价的改变可知,一个分子可得6个电子,而一个氯气分子可得2个电子,并且由阿伏加德罗定律可知,体积比等于物质的量比,故两气体能得电子相等:10×6=x×2,可知相同状况下10 L O3与30L Cl2的消毒能力相当
(3)由阿伏加德罗定律可知:2A+3O2=2F2,由原子守恒得A的化学式为O3F2
本题难度:简单
3、选择题 若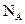 代表阿伏加德罗常数,下列说法正确的是?(?)
代表阿伏加德罗常数,下列说法正确的是?(?)
A.1 molCl2参加反应转移电子数一定为2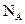
B.将31g的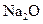 溶解于1L水中,所得溶液中
溶解于1L水中,所得溶液中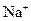 的物质的量浓度为1 mol/L
的物质的量浓度为1 mol/L
C.常温常压下,22.4L的NH3和16g CH4中所含有的电子数都是10NA
D.
参考答案:D
本题解析:略
本题难度:一般
4、选择题 NA为阿伏加德罗常数,下列叙述中正确的是(?)
A.标准状况下,22.4L己烷中共价键数目为19NA
B.通常状况下,14g乙烯与丙烯混合物中所含碳原子数为2.5NA
C.在常温常压下,2.24L甲烷中所含分子数小于0.1NA
D.1mol苯分子中含有碳碳双键数为3NA
参考答案:C
本题解析:
A.要想动用22.4L/mol,前提:①标况②气态;己烷标况下为液态;
B.乙烯与丙烯最简式:CH2,14g乙烯与丙烯混合物中所含碳原子数为NA ;
D.苯分子中并没有真正的单双键交替,是一种独特的共价键,介于单键和双键之间的键。
本题难度:简单
5、选择题 在标准状况下,mg气体A与ng气体B的分子数相同,下列说法中正确的是
[? ]
A.A与B两种气体的相对分子质量之比为m :n
B.同温同压下,两气体A与B的密度之比为n :m
C.同质量的A.B两种气体的分子数之比为m :n
D.相同状况下,同体积的气体A和B的质量比为n :m
参考答案:A
本题解析:
本题难度:一般