1、选择题 与Ne核外电子排布相同的离子跟与Ar核外电子排布相同的离子形成的化合物是
[? ]
A.MgBr2
B.Na2S
C.KCl
D.HF
参考答案:B
本题解析:
本题难度:简单
2、填空题 数10亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的主要成分
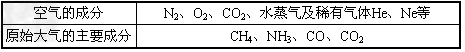
用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)____;
(2)由极性键构成的非极性分子有____;
(3)与H+可直接形成配位键的分子有____;
(4)沸点最高的物质是____,用所学知识解释其沸点最高的原因____;
(5)分子中不含孤对电子的分子(除稀有气体外)有____,它的立体构型为________;
(6)极易溶于水、其水溶液呈碱性的物质的分子是____,它之所以极易溶于水是因为它的分子和水分子之间可形成____;
(7)CO的结构可表示为OC,与CO结构最相似的分子是____,这两种结构相似的分子中,分子的极性____(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
参考答案:(1)H2O、Ne、CH4、NH3
(2)CH4、CO2
(3)NH3、H2O
(4)H2O;液态水中存在氢键,使分子间作用力增大,沸点升高
(5)CH4;正四面体形
(6)NH3;氢键
(7)N2;不相同;配位键
本题解析:
本题难度:一般
3、选择题 2006年8月,冥王星被宣布逐出行星家族,目前其地表组成还不太清楚。据科学家估计:其地表上光亮 的部分可能覆盖着一些固体氮、CO以及少量的固体CH4等碳氢化合物。下列说法不正确的是
[? ]
A.冥王星上若存在冰甲烷(CH4·nH2O),则甲烷分子与水分子是以氢键结合
B.由于N2分子中氮氮键键能较大,因此其沸点高于CH4
C.碳氢化合物中可能既有极性键又有非极性键
D.碳氢化合物形成的晶体均属于分子晶体
参考答案:AB
本题解析:
本题难度:简单
4、填空题 下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体。
单质
| a
| b
| c
| d
| e
|
沸点(℃)
| 58.8
| 882.9
| 444.7
| 2 355
| 1 107
|
(1) a的元素在元素周期表中的位置为________。
(2) 写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类型),溶于强碱的离子方程式为________________________________________。
(3) c与氢形成的分子X的空间构型为________;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式___________________________________。
(4) 上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为____________________________。
(5) b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是________。
参考答案:(11分 除注明外每空1分)(1)第四周期第ⅦA族
(2)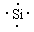 ; 原子; Si+2OH-+H2O=SiO32-+2H2↑
; 原子; Si+2OH-+H2O=SiO32-+2H2↑
(3)V型? H2S+2OH-=S2-+H2O?(4)Mg2+ ?H2SO4?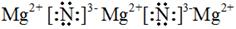 ?
?
(5)4个Na+? 4个Cl-(2分)
本题解析:钠和镁形成的晶体是金属晶体,钠离子半径大于镁离子比较,所以金属镁的沸点高于钠的。b、e均是热和电的良导体,所以b是钠,e是镁。硅是原子晶体,沸点最高,所以d是硅。S和单质溴形成的晶体均是分子晶体,其中S单质的沸点高于单质溴的,所以a是溴,c是S。
(1)溴位于元素周期表的第四周期第ⅦA族。
(2)硅位于第二正确第ⅣA族,其电子式是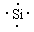 。二氧化硅形成的晶体是原子晶体。单质硅能和氢氧化钠溶液反应,反应的离子方程式是Si+2OH-+H2O=SiO32-+2H2↑。
。二氧化硅形成的晶体是原子晶体。单质硅能和氢氧化钠溶液反应,反应的离子方程式是Si+2OH-+H2O=SiO32-+2H2↑。
(3)H2S分子中S原子含有的孤对电子对数=(6-2×1)÷2=2,所以H2S是V形结构。H2S是二元弱酸,所以和过量的氢氧化钠溶液反应的离子方程式是H2S+2OH-=S2-+H2O。
(4)在核外电子排布相同的条件下,微粒半径随原子序数的增大而减小,所以形成的简单离子中半径最小的是Mg2+。非金属性越强,最高价氧化物水化物的酸性越强,所以最高价氧化物对应水化物酸性最强的H2SO4。氮元素和镁形成的化合物氮化镁是含有离子键的离子化合物,电子式是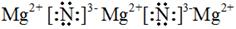 。
。
(5)根据氯化钠的晶胞结构可知,1个晶胞内含有的基本微粒及个数是4个Na+和4个Cl-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、选择题 某种具有净水作用的无机高分子混凝剂的化学式可以表示为 [Al2(OH)nClm·yH2O]x ,式中的m等于
[? ]
A、3-n
B、6-n
C、n+6
D、n+3
参考答案:B
本题解析:
本题难度:简单