| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《离子方程式的书写及正误判断》考点巩固(2020年最新版)(四)
参考答案:A 本题解析:A.将过量SO2通入冷氨水中:SO2+NH3·H2O 本题难度:一般 3、选择题 下列离子方程式书写正确的是( ) |
参考答案:B
本题解析:略
本题难度:一般
4、选择题 能正确表示下列反应的离子方程式是 ( )
A.向漂粉精溶液中通入过量的二氧化碳Ca2+ + 2ClO-+ H2O + CO2 = CaCO3↓+ 2HClO
B.金属钠与足量水反应 Na+2H2O=Na++H2↑+2OH-
C.碳酸氢钙溶液中加入足量烧碱溶液 HCO3-+OH-=CO32-+H2O
D.Cl2与水反应 Cl2+H2O=H++Cl-+HClO
参考答案:D
本题解析:A项二氧化碳过量生成HCO3-,B项电荷不守恒,C项生成的CaCO3难溶不能拆。答案选D。
考点:离子方程式正误判断
点评:离子方程式正误判断要注意:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:困难
5、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO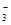 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO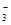 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为 L(标准状况)
参考答案:(每空3分)(1)6NO3-+10Al+18H2O=10Al(OH)3+3N2↑+6OH- (2)2H2O+O2+4e-=4OH-
(3)2Al(s)+Fe2O3(s)==2Fe(s)+Al2O3(s)△H=-593.1kJ/mol; (4)2.016
本题解析:(1)由金属铝将水体中的NO3-转化为N2可知,反应中Al元素被氧化,化合价由0价升高到+3价;N元素被还原,化合价从+5价降低到0价,则根据电子得失守恒可知反应的离子方程式为6NO3-+10Al+18H2O=10Al(OH)3+3N2↑+6OH-;
(2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,正极反应为2H2O+O2+4e-=4OH-;
(3)由①4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol,②Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s)△H=+234.1kJ/mol,③C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,根据盖斯定律可知,①×
CO2(g)+2Fe(s)△H=+234.1kJ/mol,③C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,根据盖斯定律可知,①× +②-③×
+②-③× 可得,2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol;
可得,2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol;
(4)由2Na+2H2O
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《氧化钠与过氧化钠.. | |