1、选择题 汽车上用的铅蓄电池是以一组充满海绵状态的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总反应为:Pb+PbO2+2H2SO4 ?2PbSO4+2H2O
?2PbSO4+2H2O
下列叙述正确的是?
A.充电时阴极反应为:Pb + SO42- -2e- =PbSO4
B.放电时,当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为1mol
C.放电时溶液中H+向负极移动
D.充电时阳极附近溶液的pH减小
参考答案:D
本题解析:充电相当于是电解,阴极得到电子,A不正确,应该是PbSO4+2e-=Pb+SO42 -。放电相当于是原电池,根据方程式可知,消耗2mol硫酸时,转移2mol电子,B不正确;原电池中阳离子向正极移动,选项C不正确;充电时阳极失去电子,电极反应式是PbSO4-2e-+2H2O=PbO2+4H++SO42 -,这说明充电时阳极附近溶液的pH减小,答案选D。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养和训练,旨在考查学生电化学原理解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。该题的关键是明确原电池和电解池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
2、填空题 (10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
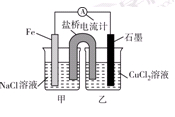
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。

Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题:
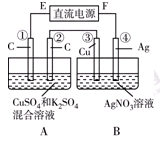
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
参考答案:Ⅰ.(1)Fe+Cu2+=Fe2++Cu ? 0.2
(2)2H++2e-=H2↑? 酸性? NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(3) 阴? 2Cl--2e-=Cl2↑
Ⅱ.(1)①0.005? ②Cu2++2e-=Cu 2H++2e-=H2↑(共1分) ?③0.025
本题解析:Ⅰ.由图可知该装置为原电池,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则Fe+Cu2+═Fe2++Cu?两极质量差△m?转移电子
56g? 64g? 56g+64g=120g? 2mol
12g? n
n=0.2mol
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,发生:NH4++H2O?NH3?H2O+H+,负极发生2H++2e-═H2↑,负极发生Fe-2e-=Fe2-。
(3)将盐桥换成弯铜导线与石墨相连成n型,则甲装置为原电池,铁做负极,铜为正极。乙装置为电解池,石墨(1)为阴极,乙装置中与铜线相连石墨电极为阳极。发生的反应式为2Cl--2e-=Cl2↑
Ⅱ.由图可知,B装置为电解池,第③极增重2.16g,发生Ag++e-=Ag,n(Ag)=0.02mol,则转移电子为0.02mol,
A池中收集到标准状况下的气体224mL,所以气体的物质的量为0.224L/22.4L/mol=0.01mol,
A装置中阳极发生4OH--4e-=O2↑+2H2O,转移0.02mol电子。第②极生成气体为0.005mol,
所以第①极上发生反应的电极反应式为
2H++2e-=H2↑,
0.01?0.005
Cu2++2e-=Cu
0.005 0.01
即Cu2+的物质的量为(0.02?0.005×2)/ 2=0.005mol,
c(Cu2+)=0.005mo/l0.2L=0.025mol/L。
本题难度:一般
3、选择题 铅蓄电池反应原理为:Pb(s)+PbO2(s) +2H2SO4(aq)  2PbSO4(s)+2H2O(l),下列说法正确的是
2PbSO4(s)+2H2O(l),下列说法正确的是
A.放电时,负极的电极反应式为:Pb – 2e-=Pb2+
B.放电时,正极得电子的物质是PbO2
C.充电时,电解质溶液中硫酸浓度减小
D.充电时,阴极的电极反应式为:PbSO4 – 2e- +2H2O=PbO2+4H++SO42-
参考答案:B
本题解析:A、根据总方程式可知,放电时,负极的电极反应式为:Pb+SO42?– 2e-=PbSO4,错误;B、放电时,正极上PbO2得电子,正确;C、根据总方程式,充电时生成H2SO4,所以硫酸的浓度增大,错误;D、充电时,阴极发生得电子反应,错误。
本题难度:一般
4、选择题 下列现象与电化学腐蚀无关的是
[? ]
A.生铁比纯铁易生锈
B.纯银饰品久置表面变暗
C.黄铜(铜锌合金)制品不易产生铜绿
D.与铜管连接的铁管易生锈
参考答案:B
本题解析:
本题难度:简单
5、选择题 为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是

A.正极的电极方程式为:O2 + 2H2O + 4e_ =" 4OH" _
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快
参考答案:D
本题解析:略
本题难度:一般