|
高中化学知识点讲解《盐类水解的原理》高频试题巩固(2020年最新版)(四)
2021-06-11 06:02:37
【 大 中 小】
|
1、填空题 (1)将该温度下a mL pH="13" NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7,
则a:b =
(2)若在含有足量AgCl固体的饱和AgCl溶液中分别放入:
A.100mL蒸馏水中;
B.100mL 0.2 mol·L-1AgNO3溶液中;
C.100 mL 0.1 mol·L-1AlCl3溶液中;
D.100mL 0.1 mol·L-1盐酸溶液中。
| 充分搅拌后,银离子浓度最小的是 (填序号)
(3)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
参考答案:(1) 1(2) C (3) 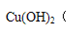 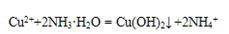 
本题解析:(1)由题意可知氢离子浓度等于氢氧根离子浓度,而氢氧根离子浓度由离子离子积常数10-14除以10-13等于0.1故氢氧根离子的物质的量为0.1a 氢离子物质的量为0.05乘以2乘以b 等于0.1b所以a:b =1 (2)C选项会抑制AgCl的电离,且氯化铝中氯的浓度最大,所以答案选C。(3)由题目可知氢氧化铜的溶解平衡常数最小,所以先生成氢氧化铜 ,
考点:考查离子平衡移动及溶解平衡的相关知识
本题难度:一般
2、填空题 直接排放含SO2,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的SO2
(1)在钠碱循环法中,Na2 SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
该反应的离子方程式是
(2)吸收液吸收SO2的过程中,pH随n(SO3²-):n(HSO3
参考答案:
本题解析:
本题难度:困难
3、填空题 (11分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,该反应的热化学方程式为 。
(2)298 K时,在固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
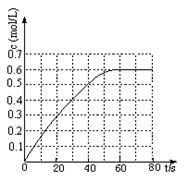
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.3" mol·mol-1,n(N2O4)="0.6" mol·mol-1,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
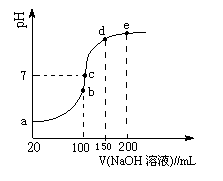
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
参考答案:(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1 (2分)
(2) ①6.67 (2分) ② a(2分) ③ < (2分) (3)①NH4+(1分)
②c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)(2分,前面不等式顺序正确1分,后面等号正确1分)
本题解析:(1)已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则1mol燃料完全燃烧释放出的热量是42.5kJ×60=2550kJ,所以该反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1。
(2)①根据图像可知平衡时N2O4的浓度是0.6mol/L,由于达平衡时,N2O4的浓度为NO2的2倍,则NO2浓度是0.3mol/L,所以该温度下平衡常数K=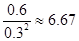 。 。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终不变,即混合气体的密度保持不变不能说明反应达到平衡状态,a正确;b、颜色深浅和浓度有关系,所以混合气体的颜色不再变化发生说明反应达到平衡状态,b错误;c、正方应是体积减小的可逆反应,因此压强是减小的,当气压恒定时可以说明反应达到平衡状态,c错误,答案选a。
③某时刻测得n(NO2)="0.3" mol·mol-1,n(N2O4)="0.6" mol·mol-1,则此时浓度商=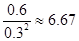 。正方应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,所以此时浓度商大于平衡常数,则反应向逆反应方向进行,即正反应速率小于逆反应速率。 。正方应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,所以此时浓度商大于平衡常数,则反应向逆反应方向进行,即正反应速率小于逆反应速率。
(3)①b点加入的氢氧化钠是100ml,恰好与溶液中的氢离子中和,因此所得溶液是硫酸钠和硫酸铵的混合液,则水解的离子是NH4+。
②c点氢氧化钠溶液的体积小于150ml而大于100ml,这说明所得溶液是硫酸钠、硫酸铵以及氨水的混合液。pH=7溶液显中性,则溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。
考点:考查热化学方程式书写、平衡状态判断、计算以及溶液中离子浓度大小比较
本题难度:困难
4、填空题 按要求完成下列化学反应式
(1)硫酸氢钠在水溶液中的电离方程式 ;
(2)Na2CO3溶液水解的离子方程式 ;
(3)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(4)Mg3N2与水反应的化学方程式 ;
参考答案:(1) NaHSO4 = Na+ + H+ + SO42-
(2)CO32-+H2O HCO3-+OH-;HCO3-+H2O HCO3-+OH-;HCO3-+H2O H2CO3+OH- ; H2CO3+OH- ;
(3)Al3++3HCO3-=Al(OH)3↓+3CO2 ↑ ;
(4)Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
本题解析:(1)硫酸氢钠为强酸酸式盐,电离产生Na+、H+、SO42?,可得电离方程式。
(2)CO32?分步水解:CO32-+H2O HCO3-+OH-;HCO3-+H2O HCO3-+OH-;HCO3-+H2O H2CO3+OH-。 H2CO3+OH-。
(3)Al3+与HCO3?发生相互促进的水解反应:Al3++3HCO3-=Al(OH)3↓+3CO2 ↑。
(4)氮化镁与水反应生成氢氧化镁和氨气:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
考点:本题考查
本题难度:一般
5、选择题 等物质的量浓度的下列溶液中,NH4+离子的浓度最大的
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.NH4NO3
参考答案:C
本题解析:NH4+离子水解显酸性,而NH4HSO4能电离出氢离子,抑制NH4+离子水解,所以NH4HSO4溶液中NH4+离子的浓度最大,答案选C。
本题难度:困难
|