1、选择题 下列实验中,有沉淀产生且不会消失的是( )
A.向澄清的石灰水中通入过量的二氧化碳
B.向硅酸钠溶液中通入过量的二氧化碳
C.向AlCl3溶液中逐滴滴入稀硫酸
D.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量
参考答案:A.沉淀先随气体体积增大而增加,Ca(OH)2全部消耗完后,沉淀先随气体体积增大而减小,直到完全没有沉淀,故A错误;
B.硅酸钠与二氧化碳反应生成硅酸,沉淀不消失,故B正确;
C.AlCl3与稀硫酸不反应,无沉淀生成,故C错误;
D.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量,先生成白色沉淀后沉淀消失,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 在水溶液中能大量共存的一组是
A.Ba2+、Na+、SO42-、Cl-
B.MnO4-、SO32-、H+、K+
C.AlO2-、Mg2+、K+、HCO3-
D.K+、Na+、NO3-、SO42-
参考答案:D
本题解析:试题分析:Ba2+与SO42-发生复分解反应,结合成白色的硫酸钡沉淀,故A选项错误;SO32-与H+发生复分解反应,结合成亚硫酸,MnO4-与SO32-、H+发生氧化还原反应,生成Mn2+、SO42-和水,故B选项错误;AlO2-、Mg2+发生双水解反应,生成氢氧化铝沉淀和氢氧化镁沉淀,Mg2+与HCO3-发生双水解反应,生成氢氧化镁沉淀和二氧化碳气体,故C选项错误;K+、Na+、NO3-、SO42-之间不能反应,故D选项正确。
考点:考查考生对中学化学常见离子的性质、离子反应发生条件的掌握程度。根据是否有难溶物、易挥发物或难电离物质的生成来判断是否能发生复分解反应;从离子性质判断是否发生氧化还原反应,进而判断离子能否大量共存。
本题难度:一般
3、选择题 能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:
B.钠与CuSO4溶液反应:
C.溶液与稀H2SO4反应:
D.向FeCl3溶液中加入Mg(OH)2:
参考答案:D
本题解析:分析:A.反应生成氯化亚铁和氢气;
B.不能置换出Cu,反应生成氢氧化铜、硫酸钠、氢气;
C.HCO3-不能拆分;
D.发生沉淀的转化,生成氢氧化铁和氯化镁.
解答:A.浓盐酸与铁屑反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.钠与CuSO4溶液反应的离子反应为2Na+2H2O+Cu2+═Cu(OH)2↓+2Na++H2↑,故B错误;
C.NaHCO3溶液与稀H2SO4反应的离子反应为HCO3-+H+═H2O+CO2↑,故C错误;
D.向FeCl3溶液中加入Mg(OH)2的离子反应为3Mg(OH)2+2Fe3+═3Mg2++2Fe(OH)3,故D正确;
故选D.
点评:本题考查离子反应书写的正误判断,明确发生的化学反应是解答本题的关键,注意物质的性质及离子反应的书写方法,题目难度不大.
本题难度:一般
4、填空题 孔雀石主要含Cu2 (OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5 H2O及纳米材料G,主要步骤如下:
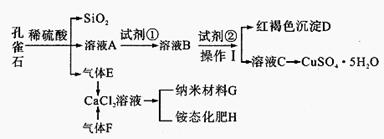
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下:
物质
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe(OH)3
| 2.2
| 3.2
|
Fe(OH)2
| 7.6
| 9.6
|
Cu(OH)2
| 4.7
| 6.4
|
请回答下列问题:
(1)写出孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式 ? 。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的?。
a.KMnO4? b.NaOH? c.H2O2? d.KSCN
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,把Fe2+氧化成Fe3+的目的是?。该工厂选用试剂①最好为下列中的?(填代号)。
a.H2O2? b.空气? c.Cl2? d.KSCN
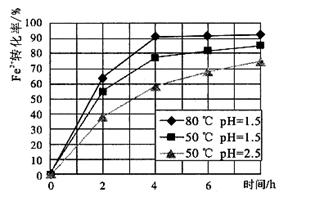
(4)根据下图有关数据,你认为工业上氧化操作时应采取的措施是?。
(5)向溶液B中加入试剂②的化学式为?,操作I的名称是?。
(6)气体E和气体F应该先通人CaCl2溶液中的是?(填化学式)。写出制备G和H的化学反应方程式?。
(7)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为? ?。取A溶液20.00 mL,用去0.0240mol/LKMnO4溶液16.00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为?。
参考答案:(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑(2分)
(2)a(1分)
(3)调节溶液的PH时,Fe3+在Cu2+开始沉淀之前就能沉淀完全,从而把铁杂质除去(1分)
a(1分)
(4)溶液温度控制在80℃,PH控制在1.5,氧化时间为4小时左右(1分)
(5)CuO(1分)?过滤(1分)
(6)NH3(1分)? 2NH3+CO2+CaCl2+H2O==CaCO3↓+2NH4Cl(2分)
(7)MnO4-+ 5Fe2+ + 8H+="==" Mn2+ + 5Fe3+ + 4H2O(2分)? 0.0960mol/L(2分)
本题解析:(1)Cu2(OH)2CO3属于碱式盐,和稀硫酸反应生成硫酸铜、CO2和水,反应式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑。
(2)亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,所以可选择a。
(3)要制备硫酸铜,则必须出去铁离子和亚铁离子。根据表中数据可知要通过沉淀法直接出去亚铁离子,则铜离子也将被同时除去,所以应该把亚铁离子氧化生成铁离子,然后再通过沉淀法出铁离子。因为当氢氧化铁完全沉淀后,铜离子还留在溶液中。所选择的氧化剂不能再引入新的杂质,所以应该选择绿色氧化剂双氧水。
(4)根据图像可知,在80℃pH等于1.5时转化率最高,所以应该控制的条件就是溶液温度控制在80℃,PH控制在1.5,氧化时间为4小时左右。
(5)要得到氢氧化铁沉淀,就有增大溶液的pH,同时还不能引入杂质,所以可选择氧化铜。要分离固液混合物,需要过滤。
(6)E是CO2,CO2和氯化钙是不反应的,要得到碳酸钙沉淀,就降低溶液的酸性,因此首先通入氨气,使溶液显碱性,然后在通入CO2即可生成碳酸钙和氯化铵。反应式为2NH3+CO2+CaCl2+H2O==CaCO3↓+2NH4Cl。
(7)参加反应的高锰酸钾是0.0240mol/L×0.016L=0.000384mol,高锰酸钾氧化亚铁离子的方程式为MnO4-+ 5Fe2+ + 8H+="==" Mn2+ + 5Fe3+ + 4H2O,所以消耗的亚铁离子为0.000384mol×5=0.00192mol,所以浓度为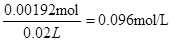 。
。
本题难度:一般
5、选择题 下列离子组在溶液中能大量共存的是
A.Fe3+、SCN-、I-、K+
B.K+、Al3+、SO42-、MnO4-
C.H+、NO3-、Fe2+、Na+
D.Cu2+、NH4+、Br-、OH-
参考答案:B
本题解析:试题分析:铁离子与硫氰酸跟离子容易发生显色反应,铁离子还能氧化碘离子,故A选项错误;K+、Al3+、SO42-、MnO4-之间不能反应,故B选项正确;亚铁离子在酸性条件下容易被硝酸根离子氧化,故C选项错误;铜离子与氢氧根离子容易反应生成氢氧化铜沉淀,铵根离子与氢氧根离子容易反应生成一水合氨或氨气、水,故D选项错误。
考点:考查离子共存,主要涉及离子之间反应生成难溶物、难电离物和易挥发物、氧化还原反应、显色反应、复水解反应等。
本题难度:一般