1、填空题 以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。

已知以下四种物质的溶解度曲线图:
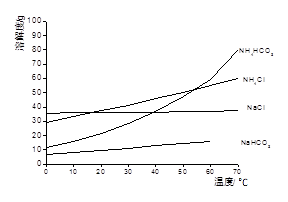
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 ?、?。
(2)“滤渣1”的化学式为?。
(3)在“滤液1”中加入盐酸的目的是?。“滤渣2”的化学式为?。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为?。
物质
| 电离常数(25℃)
|
H2CO3
| K1=4.4X10-7?K2=4.7X10-11
|
H2SO3
| K1=1.23X10-2?K2=5.6X10-8
|
?
参考答案:(16分)(1)Mg (OH)2(2分)? CaCO3(2分)
(2)NaHCO3(3分)
(3)除去HCO3-(3分,多答“使更多的Na+形成NaCl析出,提高NH4Cl的纯度”不扣分)?NaCl(3分)
(4)NaHCO3+SO2 = NaHSO3+ CO2(3分)
本题解析:(1)依题意,除杂步骤涉及的反应为Ca(OH)2+Mg2+=Mg(OH)2+Ca2+,CO2+2NH3?H2O=2NH4++CO32-+H2O,Ca2++CO32-=CaCO3↓,则废渣的主要成分是Mg(OH)2、CaCO3;(2)由溶解度曲线可知,NaHCO3的溶解度最小,最先达到饱和,则NH4HCO3与饱和NaCl具备发生复分解反应发生的条件,即NH4HCO3+NaCl=NaHCO3↓+NH4Cl,因此滤渣1的主要成分是NaHCO3;(3)过滤后滤液1中的主要成分是NaCl、NH4Cl、NaHCO3,氯化纳和氯化铵都不能与盐酸反应,而碳酸氢钠与盐酸能反应,即HCO3-+H+=CO2↑+H2O,因此加入足量盐酸能除去HCO3-,提高NH4Cl的纯度;由溶解度曲线可知,热溶液中NaCl的溶解度小于NH4Cl,因此蒸发浓缩、趁热过滤得到的滤渣2为NaCl,而滤液则含有NH4Cl、NaCl;由于NH4Cl的溶解度随温度降低明显减小,而NaCl的溶解度随温度降低无明显变化,则蒸发浓缩、冷却结晶可制备NH4Cl晶体;(4)滤渣1为NaHCO3,根据表中的电离常数可知电离程度:H2SO3>H2CO3>HSO3->HCO3-,根据复分解反应发生的条件可知,通入SO2的反应为NaHCO3+SO2=NaHSO3+CO2,不可能为2NaHCO3+SO2=Na2SO3+2CO2+H2O,因为CO2+H2O+Na2SO3= NaHSO3+NaHCO3。
本题难度:困难
2、选择题 自然界里常见金属元素存在最多的是Al,其次是铁,而铜的含量较少。但是人类冶炼金属获得成功最早的反而是含量少的铜,含量最多的铝最迟冶炼出来,究其原因,下列说法中合理的是
A.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
B.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现
C.铜矿较易还原,铝矿很难还原
D.以上说法是错误的
参考答案:C
本题解析:自然界中铝的含量比铜多,但铜的使用比铝早,原因是铝比铜活泼,铜易冶炼而铝不易冶炼。
点评:金属活动性顺序表中,K、Ca、Na、Mg、Al一般用电解法冶炼;Zn、Fe、Sn、Pb、Cu一般用还原法冶炼;Hg、Ag一般用加热法冶炼。
本题难度:一般
3、选择题 化学与科学、技术、社会、生活、环境密切相关,下列有关说法正确的是(?)
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境
C.“低钠盐”就是氯化钠中加入一定量的氯化钙,降低钠元素的含量
D.煤经过气化和液化两个物理变化,可变为清洁能源
参考答案:B
本题解析:
正确答案:B
A.不正确,绿色化学的核心内容之一是“原子经济性”,即充分利用反应物中的各个原子,因而既能充分利用资源,又能防止污染。绿色化学的核心内容之二,其内涵主要体现在五个“R”上:第一是Reduction一一“减量”,即减少“三废”排放;第二是Reuse——“重复使用”,诸如化学工业过程中的催化剂、载体等,这是降低成本和减废的需要;第三是Recycling——“回收”,可以有效实现“省资源、少污染、减成本”的要求;第四是Regeneration——“再生”,即变废为宝,节省资源、能源,减少污染的有效途径;第五是Rejection ——“拒用”,指对一些无法替代,又无法回收、再生和重复使用的,有毒副作用及污染作用明显的原料,拒绝在化学过程中使用,这是杜绝污染的最根本方法。
B.正确,淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境
C.不正确,“低钠盐”,是以碘盐为原料,再添加了一定量的氯化钾和硫酸镁,从而改善体内钠(Na+)、钾(K+)、镁(Mg2+)的平衡状态,预防高血压。因此低钠盐最适合中老年人和患有高血压、心脏病患者长期服用
D.不正确,煤经过气化和液化两个化学变化,可变为清洁能源
本题难度:一般
4、填空题 (1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:_________________________________________________;
②写出“联合制碱法”有关反应的化学方程式_________________?_;?。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
①炼钢时,加入硅、锰和铝的目的是_______________________________。
②不锈钢含有的Cr元素是在炼钢过程的氧吹__?__(填“前”或“后”)加入。
③炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
参考答案:(1)①2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O?(2分)
2NH3↑+CaCl2+2H2O?(2分)
②NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl?(2分)
2NaHCO3 Na2CO3+CO2↑+H2O?(2分)
Na2CO3+CO2↑+H2O?(2分)
(或写总反应方程式:2NaCl+2NH3+CO2+H2O=Na2CO3+2NH4Cl)
③“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气;(2分)
(2)①脱氧和调整钢的成分?(2分)
②后 (1分)
③CO (2分)?燃料(或还原剂)?(2分)
本题解析:(1)?①氨碱法中为回收氨而使石灰乳与副产物氯化铵反应,从而产生大量CaCl2废渣。2NH4Cl + Ca(OH)2=CaCl2+2H2O+2NH3↑;②联合制碱法的主要化学反应为:
NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl? 2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
③氨碱法的CO2来源于石灰石的煅烧,“联合制碱法”的CO2来源于合成氨工业的废气;
(2)①炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分;②?因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去;③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理。
本题难度:一般
5、选择题 下列金属在自然界中以游离态存在的是( )。
A.Na
B.Mg
C.Al
D.Au
参考答案:D
本题解析:金属在自然界中的存在状态与其化学活动性有关,化学性质活泼的金属在自然界中总是以化合态存在,而化学性质不活泼的金属在自然界中可以以游离态存在。
本题难度:简单