1、实验题 Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(I)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)在(I)中,刚通入CO2时发生的反应化学方程为?而后又发生反应的离子方程式为?
在(Ⅱ)中煮沸溶液的目的是?
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是?。
(2)按该同学的设计,第(I)步实验装置如下:

①装置A使用的试剂是?(固体)和?;
②装置B使用的试剂最好是?(选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是?,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有?。
参考答案:(13分)(1)2NaOH+ CO2= Na2CO3+H2O(1分)
CO32-+H2O+ CO2=2HCO3-(2分)
除去过量或多余的CO2气体,防止碳酸氢钠分解。(2分)
OH-+ HCO3-= CO32-+H2O(2分)
(2)①石灰石?盐酸(各1分)?②饱和碳酸氢钠溶液
除去CO2气体中混有的HCl气体(各1分)
NaCl? NaOH (各1分)
本题解析:
在(I)中,刚通入CO2时发生的反应化学方程为2NaOH+ CO2= Na2CO3+H2O而后又发生反应的离子方程式为CO32-+H2O+ CO2=2HCO3-
在(Ⅱ)中煮沸溶液的目的是除去过量或多余的CO2气体,防止碳酸氢钠分解。
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是OH-+ HCO3-= CO32-+H2O;①装置A使用的试剂是石灰石(固体)和盐酸;
②装置B使用的试剂最好是饱和碳酸氢钠溶液,作用是除去CO2气体中混有的HCl气体,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有NaCl? NaOH 2CO3制备实验
点评:此题考查学生对碳酸钠的熟练程度,特别注意的地方是:整个过程中对实验目的的把握。
本题难度:一般
2、选择题 下列有关Na2CO3和NaHCO3的说法,错误的是
A.都易溶于水
B.水溶液都显碱性
C.都能与盐酸反应
D.加热都能分解
参考答案:D
本题解析:所有钠盐都易溶于水,A对;B.碳酸根离子和碳酸氢根离子都会发生水解水溶液都显碱性,B对;C.都能与盐酸反应,生成CO2 NaHCO3产生气体速度大于Na2CO3产生气体速度,C对;D.NaHCO3不稳定,加热易分解:2NaHCO3=(加热)Na2CO3+CO2↑+H20,Na2CO3加热不分解,D错误。选D.
本题难度:简单
3、填空题 三种短周期元素X、Y、Z两两之间可形成原子个数比均为1:1的三种化合物A、B、C。已知A、B均为离子晶体,构成A晶体的阴离子X-和构成B晶体的阳离子Z+分别与He和Ne具有相同的核外电子排布,常温下,A、B与水都能发生剧烈反应,分别生成无色气体R和W;由X、Y两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,放出气体W。据此回答:
(1)Y是??(填元素名称)
(2)向C的水溶液中滴入紫色石蕊试液充分振荡后石蕊试液褪色,说明C具有?性。
(3)化合物B的电子式为??
(4)写出A与水反应的化学方程式??
参考答案:(1)氧
(2)氧化
(3)Na+ [:O:O: ]2-Na+
(4)NaH+H2O=NaOH+H2↑
本题解析:根据题意可知:X为氢,Y为氧,Z为钠,A为NaH,B为Na2O2,C为H2O2,NaH+H2O=NaOH+H2↑
本题难度:简单
4、选择题 下列对碱金属性质的叙述中,正确的是(? )
A.都是银白色的质软金属,密度都很小
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水剧烈反应生成碱和H2
D.单质熔沸点随着原子序数的增加而升高
参考答案:AC
本题解析:本题主要考查碱金属的性质。碱金属单质在空气中燃烧时,活动性不同,其产物不同,Li生成Li2O,Na生成Na2O2,K、Rb、Cs则生成更复杂的氧化物,B不对;碱金属单质熔沸点随着原子序数增加逐渐降低,D错误。
本题难度:简单
5、实验题 某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为:?
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是:?。
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为:??。
方案三:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是:?,沉淀经干燥后称量为m2g。
(2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”)
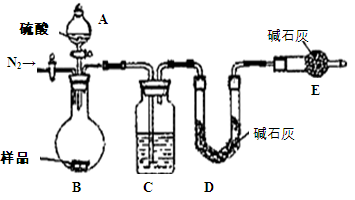
方案四:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用如图装置,C中盛放的物质是?。
(2)反应前后都要通入N2,反应后通入N2的目的是:?
参考答案:方案一:(1)2NaHCO3=Na2CO3+CO2↑+H2O
(2)加热至恒重,以保证NaHCO3全部分解
方案二: ?或
?或 (3分)
(3分)
方案三:(1)洗涤沉淀 (2)能
方案四:(1)浓硫酸 (2)将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收
本题解析:方案一:该方案原理为:在加热条件下Na2CO3能够稳定存在,而NaHCO3易发生分解反应,从而根据残留的固体的量推算出样品中碳酸钠的质量分数;(1)坩埚中发生反应的化学方程式为:2NaHCO3 Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;
Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;
方案二:该实验方案的原理为用双指示剂法测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,以酚酞作指示剂,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,再以甲基橙作指示剂,发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑,根据上述原理,以酚酞作指示剂,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,n(Na2CO3)="n(HCl)=" 10×0.1mol/L×0.001V1L="0.001" V1 mol,m(Na2CO3)="0.106" V1g,碳酸钠的质量分数为0.106 V1g/mg×100%="10.6" V1/m%;
方案三:该实验方案的原理为:纯碱样品中的碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和水,通过测定碳酸钙的质量来确定碳酸钠的质量分数;(1)碳酸钙沉淀会附着氯化钠、氯化钙等杂质,过滤后需用蒸馏水洗涤沉淀;(2)在一定量样品中加入足量Ca(OH)2溶液分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总质量和生成CaCO3沉淀的量,可以计算碳酸钠质量,能测得碳酸钠的质量分数;
方案四:该实验方案的原理为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,
2NaHCO3+ H2SO4= Na2SO4+H2O+CO2↑,通过准确测定样品的质量和二氧化碳的质量,来计算碳酸钠的质量分数;(1)该反应产生的二氧化碳中含有水蒸气,会影响二氧化碳质量的测定,必须除去,故C装置的作用为干燥二氧化碳,盛放的物质是浓硫酸;(2)该方案关键是要准确测量产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被D中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收。
本题难度:困难