1、简答题 从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(一)海水淡化的方法主要有______(填一种).
(二)从海水中提取溴和镁的流程如图所示:
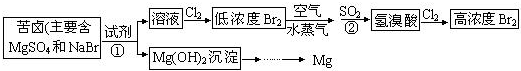
(1)提取Br2时,第一次通入Cl2后发生反应的离子方程式是______;②中SO2表现______(填“氧化”或“还原”)性;第二次通入Cl2后,要提取Br2还要进行的操作为______.
(2)为了实现对镁离子的富集,①中加入的足量试剂是______(填化学式);
试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是______(填字母).
A.Mg(OH)2
MgOMg
B.Mg(OH)2MgOMg
C.Mg(OH)2无水MgCl2Mg
D.Mg(OH)2MgCl2溶液Mg.
参考答案:(一)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏、电渗析以及离子交换法等,最简单的是蒸馏的方法,故答案为:蒸馏;
(二)向苦卤中加入试剂①得到Mg(OH)2,且不能引入新的杂质离子,则①应该是NaOH,Mg(OH)2溶于稀盐酸得到MgCl2溶液,将MgCl2.6H2O在HCl氛围中脱水得到MgCl2,电解熔融MgCl2得到Mg;
向溶液中通入过量Cl2,发生反应2Br-+Cl2=2Cl-+Br2,得到低浓度的Br2,用热空气将Br2吹出,然后用二氧化硫还原溴得到溴离子,反应方程式为SO2+2H2O+Br2=H2SO4+2HBr,向氢溴酸中通入氯气,发生反应2Br-+Cl2=2Cl-+Br2,从而得到高浓度的Br2,
(1)通过以上分析知,提取Br2时,第一次通入Cl2后发生反应的离子方程式是2Br-+Cl2=2Cl-+Br2;②中发生的反应为SO2+2H2O+Br2=H2SO4+2HBr,S元素化合价由+4价变为+6价,所以SO2表现还原性;从溴水中获取溴单质采用萃取的方法,所以第二次通入Cl2后,要提取Br2还要进行的操作为萃取,
故答案为:2Br-+Cl2=2Cl-+Br2;还原;萃取;
(2)通过以上分析知,为了实现对镁离子的富集,①中加入的足量试剂是NaOH,
A.氧化镁熔点很高,电解熔融态氧化镁会增加成本,故不适合;
B.真空、高温还原MgO增加成本,且条件难以控制,故不适合;
C.镁是活泼金属,采用电解熔融氯化镁的方法冶炼镁,故适合;
D.镁是活泼金属,不能采用置换法获取,故不适合;
故选C;
故答案为:NaOH;C.
本题解析:
本题难度:一般
2、选择题 从海水中提取镁,最基本的方法是往海水里加碱,得到Mg(OH)2沉淀,将沉淀分离出来后再加入盐酸把它变成MgCl2;之后,经过滤、干燥、电解,即可得到金属镁。下列对从海水中提取镁的有关说法中,正确的是
[? ]
A.整个过程中没有涉及置换反应
B.往海水里加碱是指直接加入NaOH
C.电解MgCl2溶液即可得到金属镁
D.电解时得到的镁蒸气应在CO2氛围中冷却
参考答案:A
本题解析:
本题难度:一般
3、选择题 以海水中常见物质A为原料可以发展很多工业,图中包含几种基本工业生产,下列判断不正确的是( )
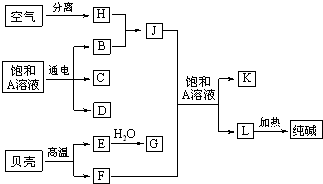
A.若C和D、C和G反应都可以制取消毒剂,则C是氯气
B.由H、B制备J是目前人工固氮的主要方式
C.制备L的正确操作是先将J通入A的饱和溶液中,再通F
D.G俗名熟石灰,L俗名苏打
参考答案:D
本题解析:
本题难度:简单
4、选择题 如今人们把食品分为绿色食品、蓝色食品、白色食品等类型.绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品.下面属于蓝色食品的是( )
A.食醋
B.面粉
C.海带
D.白酒
参考答案:C
本题解析:
本题难度:简单
5、选择题 海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
[? ]
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Na
D.利用潮汐发电是将化学能转化为电能
参考答案:C
本题解析:
本题难度:简单