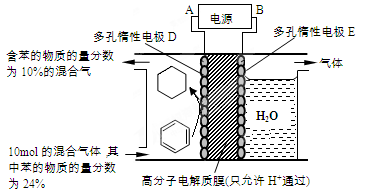
1、选择题 如图是198?K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
[? ]
A.该反应的热化学方程式为:N2+3H2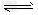 2NH3 ΔH=-92?kJ/mol
2NH3 ΔH=-92?kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1?mol?N2和3?mol?H2反应后放出的热量为Q1kJ,若通入2?mol?N2和6?mol?H2反应后放出的热量为Q2?kJ,则184>Q2>2Q1
2、填空题 (1)已知:①Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ·mol-1。
②1/2Ti(s)+ Cl2(g) =1/2TiCl4(1) △H=-385 kJ·mol-1。
则2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)的反应热为△H= 。
(2)已知甲醇(CH3OH)在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为_______ _____ __。
(3)将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池
正极反应式为__________________ ______________。
(4)右图为工业上氯碱工业的电解槽示意图,据图回答:

①该电解槽中发生反应的总离子反应方程式为
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为______ ____________________。
3、填空题 (3分)下表列出了几种键的键能:
化学键
| H—H
| Cl—Cl
| H—Cl
|
键能/kJ·mol-1
| 436
| 243
| 431
|
请根据以上信息写出氢气在氯气燃烧生成氯化氢气体的热化学方程式:
。
4、选择题 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g)+Q1,H2(g)+Br2(g)=2HBr(g)+Q2 有关上述反应的叙述正确的是
[? ]
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出Q1热量
D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
5、填空题 (14分)目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s) △H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为 L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是 (填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
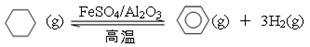
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= 。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为 。