1、选择题 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
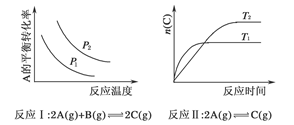
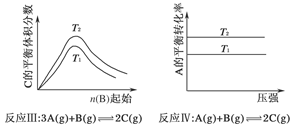
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH<0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1
D.反应Ⅳ:ΔH<0,T2>T1
参考答案:BC
本题解析:本题通过图像设置情况考查外界条件对平衡移动的影响,主要考查考生对平衡移动原理的理解能力及逻辑思维能力和识图能力。反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图像,压强增大,A的转化率应增大,所以p2>p1,随温度的升高A的转化率减小,所以正反应为放热反应,ΔH<0,故A错。关于反应Ⅱ,由图像可以看出,T1条件下达到平衡所用时间短,所以T1>T2,而在T1条件下达平衡时n(C)小,说明低温有利于C的生成,故它的正反应为放热反应,ΔH<0,B正确;关于反应Ⅲ,由图像可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应应为吸热反应,ΔH>0,而当T2<T1时,正反应应为放热反应,ΔH<0,故C正确;关于反应Ⅳ,由图像可以看出,T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向移动,因此正反应为吸热反应,ΔH>0,所以D错。
本题难度:一般
2、填空题 (14分)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入等量的NH3气体,使之发生反应:2NH3(g) 3H2(g)+N2(g),并达到平衡。则:
3H2(g)+N2(g),并达到平衡。则:
(1)达到平衡所需要的时间:t(A)?t(B),NH3的转化率:a(A)?a(B) (填“>”、“=”或“<”)。
(2)反应过程中的反应速率:v(A)?v(B) (填“>”、“=”或“<”)。
(3)达到平衡后,在两容器中分别通入等量的氦气。则B中的化学平衡向?反应方向移动,A中的化学反应速率?(填“增大”、“减小”或“不变”)。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量?,B容器中NH3的百分含量?(填“增大”、“减小”或“不变”)。
参考答案:(1)<,<(2)>(3)正,不变(4)减小,不变
本题解析:A容器相当于B容器加压,所以A容器的速率快v(A)> v(B),t(A) < t(B)。增大压强平衡逆向移动,所以NH3的转化率:a(A)< a(B)。达到平衡后,A容器中通入氦气,不影响任何与反应有关的物质的浓度,反应速率不变,B容器中通入氦气,体积增大,相当于减压,平衡正向移动。达到平衡后,向两容器中分别通入等量的原反应气体,A容器相当于加压,平衡逆向移动,H2的百分含量减小,B容器体积增大,但是平衡不移动,NH3的百分含量不变。
点评:本题解决的关键就是要找出A、B两容器如何建立等效。
本题难度:一般
3、选择题 已知450℃时,反应H2(g)+I2(g) 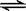 ?2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
?2HI(g)的K=50,由此推测在450℃时,反应2HI(g) 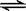 ?H2(g)+I2(g)的化学平衡常数为
?H2(g)+I2(g)的化学平衡常数为
A.50
B.0.02
C.100
D.无法确定
参考答案:B
本题解析:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。所以同一个可逆反应中逆反应的平衡常数是正方应平衡常数的倒数,因此反应H2(g)+I2(g) 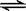 ?2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
?2HI(g)的K=50,由此推测在450℃时,反应2HI(g) 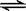 ?H2(g)+I2(g)的化学平衡常数为K=
?H2(g)+I2(g)的化学平衡常数为K=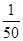 =0.02,答案选B。
=0.02,答案选B。
本题难度:一般
4、选择题 在体积不变的密闭容器中,2NO2(g) 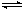 ?N2O4(g) 达到平衡的标志是
?N2O4(g) 达到平衡的标志是
①消耗1 mol NO2的同时消耗1 mol N2O4 ?②容器内NO2 和N2O4的物质的量相等
③混合气体的颜色不再改变?④容器内NO2的物质的量浓度不再变化
A.①②
B.①②③
C.③④
D.①③④
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项④正确。颜色的深浅和浓度有关系,混合气体的颜色不再改变,说明NO2的浓度不再发生变化,所以选项③可以说明。①中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不能说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,②不能说明,因此答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
5、填空题 化学反应原理在科研和生产中有广泛应用。
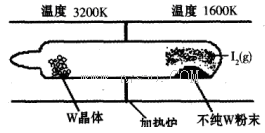
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
①反应(I)的平衡常数表达式K=_______,若K=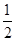 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中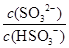 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-): n ( HSO3-)
| 91:9
| 1:1
| 1:91
|
pH(25℃)
| 8.2
| 7.2
| 6.2
|
?
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
参考答案:(1)①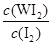 ?(2分,化学式写错不得分,漏写“c( )”其他正确只得1分)?33.3%?或33%(2分,合理答案即可)② <(2分,写“小于”不得分)? I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c2分,其他情况不得分,大写字母不得分)
?(2分,化学式写错不得分,漏写“c( )”其他正确只得1分)?33.3%?或33%(2分,合理答案即可)② <(2分,写“小于”不得分)? I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c2分,其他情况不得分,大写字母不得分)
(2)1.0×10-2(2分,或10-2或0.01)?减小 (2分)
(3)c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)(2分,顺序错误不得分,离子符号写错不得分,漏写“c( )”其他正确只得1分)
本题解析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据反应的方程式W(s)+I2(g) WI2(g)可知,该反应的平衡常数表达式K=
WI2(g)可知,该反应的平衡常数表达式K=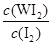 ,根据方程式可知
,根据方程式可知
W(s)+I2(g) WI2(g)
WI2(g)
起始量(mol)? 1? 0
转化量(mol)? x? x
平衡量(mol)? 1-x? x
由于反应前后体积不变,则可以用物质的量代替浓度表示平衡常数
所以K=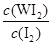 =
=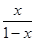 =
=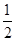
解得x=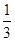
所以反应达到平衡时I2(g)的转化率为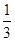 ×100%=33.3%。
×100%=33.3%。
②根据装置图可知,单质W在温度较高的情况下有利于生成,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应,即△H<0。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此判断。a.平衡时浓度不变,但物质的浓度之间不一定相等或满足某种关系,所以I2与WI2的浓度相等不能说明反应达到平衡状态,a不正确;b.W的质量不再变化,说明正逆反应速率相等,达到平衡状态,b正确;c.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此密度是变化的,所以当容器内混合气体的密度保持不变时可以说明反应达到平衡状态,c正确;d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等,但二者的反应速率方向是一致的,因此不能说明反应达到平衡状态,d不正确,答案选bc。
(2)NaHSO3的水解方程式为HSO3-+H2O H2SO3+OH-,则水解平衡常数表达式=
H2SO3+OH-,则水解平衡常数表达式=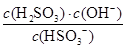 ,则
,则 =
=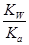 =1.0×10
=1.0×10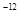 mol/L,所以该温度下H2SO3
mol/L,所以该温度下H2SO3 HSO3-+H+的电离常数Ka=
HSO3-+H+的电离常数Ka=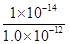 =1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中
=1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中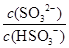 将减小。
将减小。
(3)根据表中数据可知,当n(SO32-): n ( HSO3-)=1:1时溶液显碱性,因此当溶液显中性时n(SO32-): n ( HSO3-)<1:1,所以溶液中离子浓度大小关系是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。
本题难度:困难