1、选择题 m g某金属M溶于盐酸中,放出的气体在标准状况下的体积为n L,并生成氯化物MCl2,则金属M的相对原子质量是( )
A.n/m
B.2m/n
C.m/22.4n
D.22.4m/n
参考答案:D
本题解析:M的氯化物的化学式为MCl2,即M元素的化合价为+2价;根据化学反应方程式:
M+2HCL="M" Cl2+H2可得金属M的相对原子质量是22.4m/n
本题难度:简单
2、选择题 下列有关说法正确的是(?)
A.9.2 g NO2气体中含有分子数目为0.2NA
B.标准状况下,2.24 L SO3中含有氧原子数目为0.3NA
C.2 g 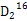 O中含中子、质子、电子数目均为NA
O中含中子、质子、电子数目均为NA
D.标准状况下2.24 L Cl2通入足量水中或NaOH溶液中,转移电子数目均为0.1NA
参考答案:C
本题解析:由于存在平衡:2NO2(g) N2O4(g),故含有的分子数<0.2NA,A错误;SO3在标准状况下是固体,B错误;2 g
N2O4(g),故含有的分子数<0.2NA,A错误;SO3在标准状况下是固体,B错误;2 g 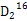 O 的物质的量为0.1 mol,而
O 的物质的量为0.1 mol,而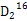 O中含中子(10)、含质子(10)、电子(10)数目均为0.1×10×NA=NA,C正确;标准状况下2.24 L Cl2即0.1 mol,由于Cl2与H2O的反应为可逆反应,故转移的电子数小于0.1NA,D错误。
O中含中子(10)、含质子(10)、电子(10)数目均为0.1×10×NA=NA,C正确;标准状况下2.24 L Cl2即0.1 mol,由于Cl2与H2O的反应为可逆反应,故转移的电子数小于0.1NA,D错误。
本题难度:一般
3、填空题 (1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式:?。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为??g。
参考答案:(4分)(1)CaCO3(s)=CaO(s) +? CO2(g)?ΔH=+175.6kJ·mol-1?(2)4.16
本题解析:(1)10g CaCO3分解需要吸收17.56kJ 热量,则1mol即100g碳酸钙分解需要消耗的能量是175.6kJ,因此该反应的热化学方程式是CaCO3(s)=CaO(s) +? CO2(g)?ΔH=+175.6kJ·mol-1。
(2)碳酸氢钠分解的方程式是2NaHCO3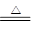 Na2CO3+H2O+CO2↑?△m↓
Na2CO3+H2O+CO2↑?△m↓
2×84g? 106g? 62g
m? 0.31g
解得m=(62g×0.31g)÷168g=0.84g
所以原混合物中碳酸钠的质量为5.00g-0.84g=4.16g
点评:该题是基础性试题的考查,难度不大,有利于培养学生规范的答题能力,在计算碳酸钠的质量时,注意利用好差量法,注意有关解题方法的归纳和总结。
本题难度:一般
4、选择题 下列叙述正确的是 ( )?
A.1 mol H2O的质量为18g/mol
B.3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:B
本题解析:质量单位是g,A错误;3.01×1023个SO2分子物质的量为0.5mol,质量为32g,B正确;摩尔质量单位是g/mol,C错误;标准状态下,1mol任何气体的体积约为22.4L,D错误。
点评:气体摩尔体积四要素:1mol、任何气体、标准状况、约为22.4L。
本题难度:简单
5、填空题 已知某饱和NaCl溶液的体积为V?mL,密度为ρ?g/cm3,质量分数为w%,物质的量浓度为c?mol/L,溶液中含NaCl的质量为m?g。
(1)用m、V表示溶液的物质的量浓度_____________________。
(2)用w、ρ表示溶液物质的量浓度____________________。
(3)用c、ρ表示溶液的质量分数__________________。
(4)用w表示该温度下NaCl的溶解度____________________。
参考答案:(1)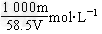
(2)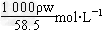
(3)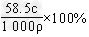
(4)
本题解析:
本题难度:一般