1、填空题 (15分) 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
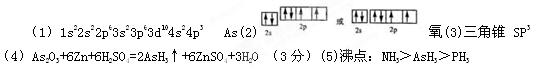
 (1)X元素原子基态时的电子排布式为?
(1)X元素原子基态时的电子排布式为?
 ?,该元素的符号是__________;
?,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为?
(2)Y元素原子的价层电子的轨道表示式为?
 ?,该元素的名称是___
?,该元素的名称是___ _______;
_______;
 (3)X与Z可形成化合物XZ3,该化合物的空间构型为____________; X原子的杂化轨道类型为_______
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________; X原子的杂化轨道类型为_______
 (4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
 (5)比较X的氢化物与同族第二、第三周期元素所形成
(5)比较X的氢化物与同族第二、第三周期元素所形成 的氢化物沸点高低顺序为?
的氢化物沸点高低顺序为?
 ?。
?。
参考答案:
本题解析:略
本题难度:简单
2、选择题 A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A≤B;⑤A的正价与B的负价绝对值一定相等。其中正确的是
A.①②
B.③④
C.③⑤
D.③④⑤
参考答案:B
本题解析:A元素的阳离子与B元素的阴离子具有相同的电子层结构,所以A的原子序数大于B的,原子半径A大于B,但离子半径是B的大于A的。其中A是金属,B是非金属位于A的上一周期的右侧。所以答案选B。
本题难度:一般
3、选择题 X、Y、Z均为元素周期表中前20号元素,mXa+、nYb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是?(?)
A.已知mXa+与nYb-,得m+a=n-b
B.离子半径:Yb->Z(b+1)-﹥Xa+
C.Z(b+1)-的还原性一定大于Yb-
D.气态氢化物的稳定性Hb+1Z一定大于HbY
参考答案:C
本题解析:mXa+、nYb-、Z(b+1)-离子的电子层结构相同,则核外电子数相同,即m-a=n+b,X处于Y、Z的下一周期,X为金属元素,Y、Z为非金属元素,X的原子序数大于Y的原子序数,Y的原子序数大于Z的原子序数,结合电子层结构相同核电荷数越大离子半径越小与元素周期律判断。
A项:根据上述分析,m-a=n+b,故错;B项:具有电子层结构相同的离子,核电核数越大半径越小,故错;D项:Y的非金属性大于Z的非金属性,故错。故选C。
点评:本题考查了半径比较、核外电子排布、结构与位置关系,难度不大,判断W、Y的位置关系是关键,要灵活运用元素周期律知识解答。
本题难度:简单
4、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| R
| W
|
原子半径/pm
| 160
| 143
| 89
| 70
| 66
|
主要化合价
| +2
| +3
| +2
| +5、-3
| -2
|
?
下列叙述正确的是
A.X、Z元素的金属性:X < Z
B.气态氢化物的稳定性:R > W
C.Y的最高价氧化物既能溶于H2SO4又能溶于NaOH
D.一定条件下,R单质与常见的W单质能直接生成RW2
参考答案:C
本题解析:由题意知X为Mg,Y为Al,Z为Be,R为N,W为O,A、X与Z主要化合价相同,即在同族,元素的原子序数越大,金属性越高,X的原子半径大于Z,金属性X>Z,故A错误;B、R与W在同一周期,越往右酸性越强,W在R右边,氢化物的稳定性越强,即氢化物稳定性R<W,故B错误;C、Y为Al,氧化铝是两性氧化物,能溶于酸也能溶于碱,故C正确;D、氮气非常稳定,无法用其制取二氧化氮,故D错误。
本题难度:一般
5、填空题 (10分)下表是元素周期表的一部分,回答下列有关问题:
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
|
3
| ③
| ④
| ⑤
| ⑥
| ?
| ⑦
| ⑧
| ⑨
|
4
| ⑩
|  | ?
| ?
| ?
| ?
|  | ?
|
⑴.在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)?,碱性最强的是?,呈两性的氢氧化物是?,
⑵.写出工业上冶炼⑤的化学方程式为??;⑤与一种黑色晶体反应冶炼铁的化学方程式为:?。
⑶.在⑧与⑦中,非金属性较强的元素是?,写出可以验证该结论的一个离子反应方程式?。
参考答案:⑴ HClO4;KOH;Al(OH)3(各1分)
⑵.2Al2O3(熔融)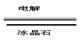 4Al+3O2↑(2分)
4Al+3O2↑(2分)
3Fe3O4+8Al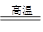 9Fe+4Al2O3(2分)
9Fe+4Al2O3(2分)
⑶.Cl;(1分)Cl2+S2-=S↓+2Cl-(2分)
本题解析:(1)酸性最强的应在右上角,但F无正价,故为HClO4;碱性最强的应在左下角,故为KOH;
(3)同周期,由左到右,元素的非金属性逐渐增强
本题难度:一般