1、选择题 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是(? )
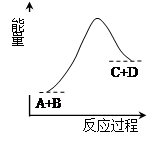
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
参考答案:B
本题解析:反应是放热反应还是吸热反应与反应条件无关系,只与反应物和生成物总能量的相对大小有关系。如果反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。根据图像可知,反应物的总能量低于生成物的总能量,所以该反应是吸热反应,答案选B。
点评:该题是基础性试题的考查,主要是有利于巩固学生的基础知识,提高学生灵活运用基础知识的能力,也有利于培养学生的应试能力和学习效率。该题的关键是明确反应热的判断依据,然后结合图像和题意灵活运用即可。
本题难度:简单
2、填空题 根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中
进行反应和测定中和反应的反应热。
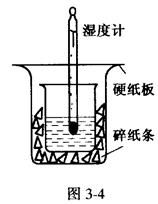
(1)图3-4装置缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是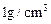 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________
(填“相同”或“不相同”)。
参考答案:(1)?环形玻璃搅拌棒?大小烧杯口没有齐平、??减小??、
(2)减小 ?
(3)--4C(t-18)KJ∕mol
(4)?增多??、相同
本题解析:略
本题难度:简单
3、选择题 根据下图所示图像,写出反应的热化学方程式并回答下列问题:
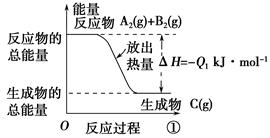
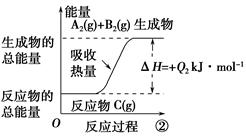
(1)反应过程①的热化学方程式为:____________________________________________。
(2)反应过程②的热化学方程式为:____________________________________________。
(3)Q2与Q1的关系:Q2________Q1(填“大于”“小于”或“等于”)。
参考答案:(1)A2(g)+B2(g)=C(g) ΔH=-Q1 kJ·mol-1
(2)C(g)=A2(g)+B2(g) ΔH=+Q2kJ·mol-1 (3)等于
本题解析:本题考查的是热化学方程式的书写。图中已清楚地标明两个反应的反应物、生成物和反应热,按照书写热化学方程式的规则,不难写出相应的热化学方程式。因为两个反应方向相反,因此其反应热数值的绝对值相等,符号相反。
本题难度:一般
4、选择题 关于下列图示的说法中正确的是( )
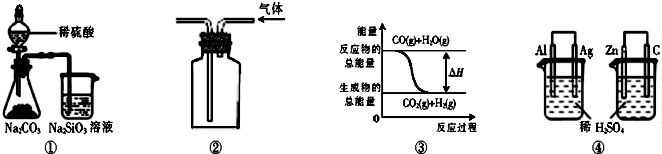
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的△H大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
参考答案:A、元素的非金属性越强,其相应最高价含氧酸的酸性越强,强酸能制取弱酸,硫酸是强酸能和碳酸钠反应生成碳酸,碳酸不稳定分解生成二氧化碳和水,二氧化碳、水和硅酸钠反应生成不溶于水的硅酸和碳酸钠,硫酸的酸性大于碳酸的酸性,碳酸的酸性大于硅酸的酸性,所以用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱,故A正确;
B、二氧化碳的密度大于空气的密度,且二氧化碳和空气中的成分不反应,所以收集二氧化碳应采用向上排空气集气法,即长管进气短管出气,故B错误;
C、该反应反应物的能量大于生成物的能量,所以是放热反应,△H小于0,故C错误;
D、Al-Ag-H2SO4原电池中负极上电极反应式为Al-3e-=Al 3+,Zn-C-H2SO4原电池中负极上电极反应式为Zn-2e-=Zn 2+,两个原电池负极上失去相同电子时消耗负极的物质的量不同,故D错误.
故选A.
本题解析:
本题难度:一般
5、选择题 下列反应中,生成物的总能量大于反应物的总能量的是
A.氢气在氧气中燃烧
B.焦炭在高温下与水蒸气反应
C.硫在氧气中燃烧
D.铁丝在氧气中燃烧
参考答案:B
本题解析:生成物的总能量大于反应物的总能量,该反应是吸热反应。所有的燃烧反应都是放热反应,焦炭在高温下与水蒸气反应是吸热反应,答案选B。
本题难度:简单