1、选择题 下列说法正确的是
A.凡是放热反应的发生均无需加热
B.凡是需要加热后才能发生的反应是吸热反应
C.伴有能量变化的物质变化都是化学变化
D.物质发生 化学反应都伴随着能量变化
参考答案:D
本题解析:判断一个反应是否是化学反应要看是否有新物质生成,而物质变化都伴随着能量变化,故选D
点评:考查化学反应的判断,难度不大
本题难度:简单
2、选择题 下列说法正确的是
 ?
?
A.AgCl难溶于水,溶液中没有Ag+和Cl-
B.自发过程将一定导致体系的熵值增大
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有过程的方向的判断
D.增大反应物的浓度可增大单位体积活化分子百分数,从而使有效碰撞次数增多
参考答案:C
本题解析:略
本题难度:一般
3、选择题 已知:2Zn(s)+O2(g)=2ZnO(s)? △H=-701.0kJ·mol-1
Hg(l)+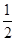 O2(g)=HgO(s)? △H=-90.8kJ·mol-1
O2(g)=HgO(s)? △H=-90.8kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A.-259.7 kJ·mol-1
B.+259.7 kJ·mol-1
C.+519.4kJ·mol-1
D.-519.4kJ·mol-1
参考答案:A
本题解析:根据盖斯定律可知,反应①÷2-②即得到Zn(s)+ HgO(s)=ZnO(s)+ Hg(l),所以该反应的反应热△H=-701.0kJ/mol÷2+90.8kJ/mol=-259.7kJ/mol,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是熟练掌握丙灵活运用盖斯定律即可。本题有利于培养学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
4、选择题 已知热化学方程式: H2O(g)=H2(g) +1/2O2(g)?△H = +241.8kJ/mol
H2(g)+ 1/2O2(g)=H2O(1)?△H =" -" 285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是?(?)
A.吸热44kJ
B.吸热2.44KJ
C.放热44kJ
D.放热2.44KJ
参考答案:B
本题解析:略
本题难度:简单
5、选择题 下列反应中生成物总能量高于反应物总能量的是
A.酸碱中和反应
B.乙醇在空气中完全燃烧
C.锌放入稀硫酸中
D.碳和水蒸气在高温下反应
参考答案:D
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。反应中生成物总能量高于反应物总能量,什么是吸热反应,D正确,其余但是放热反应,所以答案选D。
本题难度:简单