1、选择题 有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是(?)?
A.D >C >A >B?B. D >A >B >C
C.D >B >A >C?D.B >A >D >C
参考答案:B
本题解析:原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属,据此可以解答。两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B;金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜。如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C,所以金属的活动性顺序为:D>A>B>C,故选B。
点评:该题是高考中的常见题型,属于中等难度的试题。有利于培养学生的逻辑推理能力和发散思维能力。答题时能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属最高价氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱,注意相关知识的积累和总结。
本题难度:简单
2、填空题 (10分)肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:

N2(g)+2O2(g)=2NO2(g)?△H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)?△H =-534. 0kJ·mol-1
2NO2(g) N2O4(g)?△H =-52.7kJ·mol-1
N2O4(g)?△H =-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_?__。
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。

①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则?平均化学反应速率v(NO2)等于____________________(用含a、t的代数式表示)。
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
参考答案:(10分)(1)N2H4-4e-+4OH-=N2+4H2O
(2)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)?△H=-947.6 kJ· mol-1
(3) 2NH3+CIO-=N2H4+Cl-+H2O
(4)①气囊B的体积不再减小或气体颜色不再变化(其他合理答案给分)
②0.7L。③? mol·L-1·s-1④变小
mol·L-1·s-1④变小
本题解析:(1)原电池中负极失去电子,正极得到电子。因此肼再负极通入,氧气在正极通入。又因为电解质是氢氧化钾,所以左侧即负极反应式是N2H4-4e-+4OH-=N2+4H2O。
(2)根据盖斯定律可知,②×2-①-③即得到反应式2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以该反应的分液△H=-534. 0kJ·mol-1×2+67.7kJ·mol-1+52.7kJ·mol-1=-947.6 kJ· mol-1。
(3)根据反应物和生成物可知,该反应的离子方程式是2NH3+CIO-=N2H4+Cl-+H2O。
(4)①由于在反应过程中气体的体积是变化的,所以可以通过气囊B的体积变化来判断,又因为NO2是红棕色的气体,所以也可以通过气体颜色的变化来判断。即气囊B的体积不再减小或气体颜色不再变化时,即说明反应到达平衡状态。
②打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的。由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL。
③设消耗NO2的物质的量是x,则根据方程式2NO2=N2O4可知,生成N2O4的物质的量是x/2,则1-x+x/2=0.8,解得x=0.4mol,所以NO2的反应速率是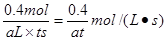 。
。
④由于反应物和生成物都是一种,所以再冲入NO2,则相当于是增大压强,平衡向正反应方向移动,因此NO2的含量降低。
本题难度:一般
3、选择题 下列实验操作或装置符合实验目的是( )
A.

用酸性KMnO4溶液滴定Na2SO3
B.
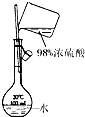
配制稀硫酸溶液
C.
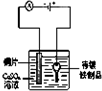
在铁制品上镀铜
D.
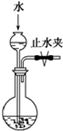
(关闭止水夹)
检查装置气密性
参考答案:A、因KMnO4溶液不能盛放在碱式滴定管中,故A错误;
B、因容量瓶不能用于稀释溶液,故B错误;
C、在铁制品上镀铜,待镀铁制品应放在阴极,故错误;
D、因漏斗中液面不下降即可证明装置气密性良好,故D正确;
故选:D.
本题解析:
本题难度:一般
4、选择题 将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置好仪器,观察下图,示意正确的是(?)

A? B? C? D
参考答案:B
本题解析:略
本题难度:简单
5、选择题 下列为原电池装置的是
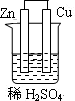
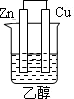
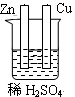
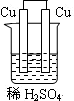
A B C D
参考答案:A
本题解析:构成原电池的条件是活泼性不同的金属(或金属与非金属)用导线相连并插入到电解质溶液中,所以A装置是原电池,B中乙醇是非电解质,C中电极没有相连,D中电极相同,均不能构成原电池,所以正确的答案选A。
考点:考查原电池构成的有关判断
点评:该题是基础性试题的考查,试题难易适中,注重基础,侧重能力的训练。该题的关键是明确构成原电池的条件,并能灵活运用即可,有利于学生的逻辑推理能力。
本题难度:一般