1、选择题 下列物质中属于非电解质的是( )
A.酒精
B.H2O
C.Na2CO3
D.NaOH
参考答案:A.酒精为化合物,再在水溶液中本身不发生电离,则属于非电解质,故A正确;
B.H2O能发生微弱电离,生成少量氢离子和氢氧根离子,属于电解质,故B错误;
C.Na2CO3在水溶液中电离出能自由移动的钠离子和碳酸根离子,属于电解质,故C错误;
D.NaOH在水溶液中电离出能自由移动的钠离子和氢氧根离子,属于电解质,故D错误.
故选A.
本题解析:
本题难度:一般
2、简答题 (1)NH4Cl溶液显______性(填“酸”、“中”或“碱”,下同),请用离子方程式解释:______.
(2)Na2CO3溶液显______性,请用离子方程式解释:______
(3)把氯化铁溶液蒸干,得到______固体,反应方程式为______;
(4)已知Al2(SO4)3水解后生成了胶体溶液可用于净水,请用离子方程式解释:______.
(5)在0.10mol?L-1的Na2CO3溶液中,下列离子浓度关系正确的是______(填写编号)
A.c(Na+)=c(CO32-)+c(HCO3-)
B.c(OH-)=c(HCO3-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
D.c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
参考答案:(1)氯化铵为强酸弱碱盐,铵根离子水解显酸性,水解离子反应为NH4++H2O?NH3.H2O+H+,
故答案为:酸;NH4++H2O?NH3.H2O+H+;
(2)碳酸钠为强碱弱酸盐,碳酸根离子水解显碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,
故答案为:碱;CO32-+H2O?HCO3-+OH-;
(3)氯化铁溶液中铁离子水解生成盐酸易挥发,蒸干得到氢氧化铁,水解离子反应为FeCl3+3H2O=Fe(OH)3+3HCl,
故答案为:Fe(OH)3;FeCl3+3H2O=Fe(OH)3+3HCl;
(4)Al2(SO4)3水解后生成了胶体,离子反应为Al3++3H2O?Al(OH)3+3H+,故答案为:Al3++3H2O?Al(OH)3+3H+;
(5)Na2CO3溶液转化存在电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒式为c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),
则c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),则CD正确,AB错误,故答案为:C、D.
本题解析:
本题难度:一般
3、选择题 下列说法中正确的是( )
A.常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
B.常温下,c(NH4+)相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.0.1mol/LNH4HSO4溶液与0.1mol/LNaOH溶液等体积混合后,溶液中离子浓度关系为:c(Na+)=c(SO42-)>c(H+)>c(NH4+)>c(OH-)
D.当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+)
参考答案:B
本题解析:
本题难度:简单
4、选择题 某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是
[? ]
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.c(NH4+)+c(H+)=c(Cl-)+c(OH-)
参考答案:D
本题解析:
本题难度:一般
5、选择题 根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是:
①HS-②CO32-③H2PO4-④NH3⑤H2S⑥CH3COOH⑦OH-⑧H2O⑨NO2- ⑩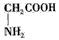
[? ]
A.①⑤
B.③⑥
C.①②⑨
D.①③⑧⑩
参考答案:D
本题解析:
本题难度:一般