AgNO3
参考答案:(12分)(1)阴极?(2)放出气体,溶液变红? 2Cl- - 2e-= Cl2↑
(3)1.28g?(4)粗铜?(5)D
本题解析:(1)X与电源的飞机相连,作阴极。
(2)惰性电极电解饱和食盐水时,阴极是氢离子放电生成氢气。同时也平衡了阴极周围水的电离平衡,导致溶液显碱性,因此溶液变成红色,电极反应式是 2Cl- - 2e-= Cl2↑。
(3)惰性电极电解硫酸铜溶液,阳极生成氧气,其物质的量是0.01mol,转移0.01mol×4=0.04mol电子。所以根据电子的得失守恒可知,阴极析出铜的物质的量是0.04mol÷2=0.02mol,质量是1.28g。
(4)粗铜精炼是阴极是纯铜,阳极是粗铜,所以Y电极材料是粗铜。
(5)电镀时待镀金属作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,所以在铁表面镀一层金属银时,阳极是银,阴极是铁,硝酸银作电解质,答案选D。
点评:在进行电化学的有关计算时,应该利用电子的得失守恒这一关系式。
本题难度:一般
2、选择题 如下图所示,其中甲池的总反应式为:2CH3OH + 3O2 + 4KOH=2K2CO3 + 6H2O,在接通电路一段时间后纯Cu质量增加了3.2 g。下列说法正确的是

[? ]
A.甲池是电能转化为化学能的装置,乙池是化学能转化电能的装置
B.甲池中理论上消耗标准状况下空气的体积是2.8 L(空气中O2体积分数以20%计算)
C.接通电路一段时间后,乙池中CuSO4溶液的浓度发生了明显的变化
D.甲池通入CH3OH的电极反应为:CH3OH-6e-+ 2H2O=CO32-+ 8H+
参考答案:B
本题解析:
本题难度:一般
3、判断题 标明下列装置中电解池的阴极和阳极,试写出电极反应式,并判断是氧化反应还是还原反应。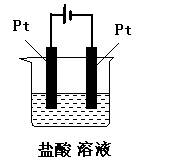
参考答案:与电源正极相连的一极是电解池的阳极,反应式为:2Cl-→Cl2↑+2e-(氧化反应);
与电源负极相连的一极是电解池的阴极,反应式为:2H++ 2e-= H2↑(还原反应)。
本题解析:在电解池中,与电源正极相连、发生的电极反应
是氧化反应的电极是阳极,与电源负极相连、发生的电极
反应是还原反应的电极是阴极。依据这个原则即可标明电
解池的阴极和阳极,试写出电极反应式,并判断是氧化反
应还是还原反应。
本题难度:一般
4、填空题 A、B、C、D、E五种物质之间的关系如下图所示,其中E为黑色物质,B为气体,C为金属,反应Ⅲ是C在D的稀溶液中进行的,则A为_______,B为______,D为______ 。
写出反应Ⅰ的离子方程式______________________________。?
参考答案:
Cu(NO3)2 O2 HNO3?

本题解析:由于电解A溶液得到金属C,并有三种产物,故说明气体为O2,D为含氧酸。C跟氧气反应生成黑色氧化物E,则E为CuO,能跟铜反应的稀酸应为稀HNO3,由上述可知:A为Cu(NO3)2,B为O2,D为HNO3。反应Ⅰ的离子方程式为:
本题难度:一般
5、选择题 如用下图I所示装置通电8分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到电流计指针发生偏转,U型管左端铁电极表面析出白色胶状物质,U型管右端液面上升。下列说法正确的是
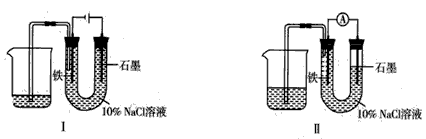
[? ]
A.通电时石墨电极上方得到的气体为H2
B.装置I通电8分钟后石墨电极周围溶液的pH上升
C.用装置Ⅱ进行实验时石墨电极的电极反应为Cl2 - 2e-==2Cl-
D.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-==Fe(OH)2
参考答案:D
本题解析:
本题难度:一般
|