1、简答题 最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功.具体生产流程如下:
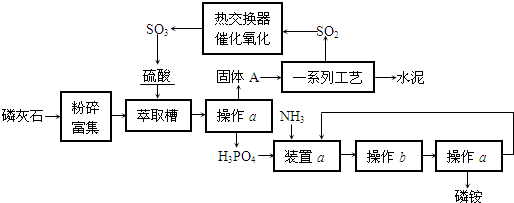
回答下列问题:
(1)若操作a、操作b均在实验室进行,则操作a时用到的玻璃仪器有______;进行操作b时需注意______.
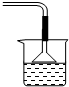
(2)装置a用磷酸吸收NH3.若该过程在实验室中进行,请画出装置a的示意图.
(3)热交换器是实现冷热交换的装置.化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______.
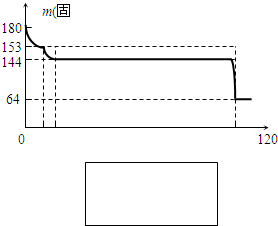
(4)固体A为生石膏(CaSO4?2H2O)和不含结晶水且高温时也不分解的杂质.生石膏在120℃时失水生成熟石膏(2CaSO4?H2O),熟石膏在200℃时失水生成硫酸钙.为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A?180g置于坩埚中加热,加热过程中固体质量随温度变化记录如图:实验中每次对固体称量时须在冷却后进行.为保证实验结果的精确性,固体冷却时必须防止______.将加热到1400℃时生成的气体通入品红溶液中,品红褪色.写出1400℃时的化学反应方程式______.③固体A中生石膏的质量分数=______.
参考答案:
(1)操作a实现固体和液体分离的方法是过滤,用到的玻璃仪器有漏斗、玻璃棒、烧杯,磷酸受热容易分解,所以在结晶时应采用低温蒸发结晶,故答案为:漏斗、玻璃棒、烧杯;低温蒸发结晶;
(2)磷酸和氨气极易反应,为防止反应过于迅速会产生倒吸的危险,要采用防倒吸装置,故答案为:
(如图或其他能防止氨气倒吸的装置);
(3)能实现气、液热交换的装置是冷凝管,下口进水伤口处谁,气体和水流方向相反,故答案为:冷凝管;
(4)①对失水后的晶体进行冷却时必须防止吸水,否则会导致结果有误差,二氧化硫能使品红溶液褪色,所以加热到1400℃时,硫酸钙分解产生了二氧化硫,即
2CaSO4?1400℃?.?2CaO+2SO2↑+O2↑,设固体A中含有生石膏的质量为m,则
CaSO4?2H20?200℃?.?CaSO4+2H20? 固体质量减少量
172? 36
m? 180g-144g
172m=36180g-144g
解得:m=172g,所以固体A中生石膏的质量分数=172g180g×100%=95.6%,故答案为:95.6%.
本题解析:
本题难度:一般
2、填空题 (1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式?;
②写出“联合制碱法”有关反应的化学方程式________________。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同______________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
① 炼钢时,加入硅、锰和铝的目的是_______________________。
② 不锈钢含有的Cr元素是在炼钢过程的氧吹____(填“前”或“后”)加入。
③ 炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
参考答案:(1)①2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
②NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl? 2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
③氨碱法中的二氧化碳来源于石灰石的煅烧,联合制碱法中的二氧化碳来自于合成氨中工业中的废气。
(2)①脱氧调整钢的成分? ②后? ③ CO?燃料或还原剂
本题解析:(1)①氨碱法中的回收氨而使石灰乳与副产物氯化铵反应,从而产生大量的废渣,2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
②联合制碱法的有关反应的化学方程式是:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl? 2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
③氨碱法中的二氧化碳来源于石灰石的煅烧,联合制碱法中的二氧化碳来自于合成氨中工业中的废气。
(2)①炼钢时,加入硅、锰和铝的目的是脱氧调研钢的成分
②因为铬易被氧化,为了防止铬被氧化,不锈钢含的铬在炼钢的过程的吹氧后,如果在吹氧前加入铬,会形成炉渣而被除去。
③炼铁和炼钢的过程中,CO主要起的作用是还原剂,所以尾气中含有污染物CO,应对CO进行处理。
本题难度:一般
3、选择题 材料是人类文明的标志,下列有关金属及材料的说法不正确的是
[? ]
A.玻璃和水泥都属于无机硅酸盐材料,其生产过程都需要使用石灰石
B.钢铁里的铁和碳在潮湿的空气中因构成原电池而易发生电化学腐蚀
C.晶体硅是重要的半导体材料,二氧化硅是制造光纤的主要材料
D.居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体
参考答案:D
本题解析:
本题难度:简单
4、选择题 美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
A.铝钠合金是混合物
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
D.若mg不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
参考答案:D
本题解析:
本题难度:简单
5、简答题 在工农业生产和日常生活中经常用到下列物质:①Si、②(NH4)2SO4、③Ca(ClO)2、④Al(OH)3、⑤Fe2O3.其中,可用于制造硅芯片的是______(填序号,下同);可用于杀菌、消毒的是______;可用作化肥的是______;可用作红色油漆和涂料的是______;医疗上可用作胃酸中和剂的是______.
参考答案:①Si原子最外层电子为4个,既难得电子,也难失去电子,可做为半导体,可用于制造硅芯片;
②(NH4)2SO4含有氮元素,氮元素为植物生长必需的营养元素,为氨盐,可用作化肥;
③Ca(ClO)2中+1价的氯具有强氧化性,能与还原性物质作用变成-1价的氯,可用于杀菌、消毒;
④Al(OH)3具有两性,作为酸时,酸性较弱,作为碱时,碱性较弱,胃酸的成分为盐酸,氢氧化铝显弱碱性,和盐酸发生中和反应,Al(OH)3医疗上可用作胃酸中和剂;
⑤Fe2O3是氧化物,颜色为红棕色,俗称为铁红,可用作红色油漆和涂料;
故答案为:①;③;②;⑤;④.
本题解析:
本题难度:一般