1、选择题 下列反应的离子方程式正确的是
A.向稀氨水中加入稀盐酸 OH- + H+ =H2O
B.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
C.碳酸钙溶于醋酸中 CaCO3 + 2H+ =Ca2+ + H2O + CO2↑
D.碳酸氢钙溶液跟稀硝酸反应 HCO3-+ H+ = H2O + CO2↑
参考答案:D
本题解析:稀氨水是弱碱溶液,不能用氢氧根离子表示,应该保留一水合氨的化学式,即NH3?H2O+H+=NH4++H2O,故A选项错误;稀硝酸是氧化性酸,能氧化亚铁离子和硫化氢,自身被还原为一氧化氮,即FeS+4H++NO3—=Fe3++S↓+NO↑+2H2O,故B选项错误;醋酸是弱酸,不能用氢离子表示,应该保留醋酸的分子式,即CaCO3+2CH3COOH=Ca2++2CH3COO—+CO2↑+H2O,故C选项错误;硝酸的酸性比碳酸强,则碳酸氢钙与稀硝酸能发生复分解反应,生成硝酸钙、二氧化碳和水,则HCO3—+H+=CO2↑+H2O,故D选项正确。
本题难度:一般
2、选择题 1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是
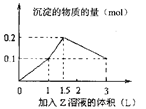
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
参考答案:C
本题解析:A.若向混合溶液中滴加NaOH溶液会发生反应:Fe3++3OH-=Fe(OH)3↓;Al3++3OH-=Al(OH)3↓立即产生沉淀.但当沉淀达到最大值后,再继续滴加会发生反应:Al(OH)3+OH-=AlO2-+2H2O。由Al3+形成沉淀和沉淀溶解的OH-的消耗量可以看出物质的量的比为:3:1,这与图像中的比例不符合。错误。B.会发生反应Mg2++2OH-=Mg(OH)3↓;Al3++3OH-=Al(OH)3↓立即产生沉淀.但当沉淀达到最大值后,再继续滴加会发生反应:Al(OH)3+OH-=AlO2-+2H2O。由Al3+形成沉淀和沉淀溶解的OH-的消耗量可以看出物质的量的比为:3:1,这与图像中的比例不符合。错误。C.若向混合溶液中滴加H2SO4溶液会发生反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O.当 该反应完全后,发生反应:2NaAlO2+H2SO4+2H2O =Na2SO4+2Al(OH)3↓.当沉淀达到最大值后继续滴加硫酸,发生反应2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.。直至氢氧化铝完全溶解。物质的量的比符合要求。正确。D.若向偏铝酸钠和氯化钡的混合溶液中滴入硫酸时发生反应:SO42-+Ba2+=BaSO4↓。AlO2-+H++H2O=?Al(OH)3↓。当第一个反应完成一半时,第二个反应进行完全。此后随着硫酸的加入。第一个反应继续进行,同时还发生反应:Al(OH)3+3H+=Al3++3H2O。沉淀的质量增加但是幅度原来小。当氯化钡反应完全,沉淀达到最大值,此后无论如何滴加,沉淀的质量也不再发生改变。错误。
本题难度:一般
3、选择题 下列化学用语表示正确的是
[? ]
A.硫酸氢钾加热熔融的电离方程式:KHSO4 = K+ + H+ +SO42-
B.氯化铵溶液显酸性的原因:NH4+ +H2O =NH3·H2O + H+
C.铅蓄电池放电时阳极反应:Pb+ SO42- -2e- = PbSO4
D.氯化铁溶液中滴加少量的硫化钠溶液:2Fe3+ +S2- = 2Fe2+ +S↓
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是
A.稀硝酸与氢氧化钾溶液反应H++OH-=H2O
B.铝与稀盐酸反应Al+2H+=Al3++H2↑
C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH-=Fe(OH)3↓+3Cl-
D.二氧化碳与石灰水反应CO2+2OH-=CO32-+H2O
参考答案:A
本题解析:判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,据此可知A正确;B、没有配平,应该是2Al+6H+=2Al3++3H2↑,B不正确;C、氯化铁应该用离子符号表示,即Fe3++3OH-=Fe(OH)3↓,C不正确;D、二氧化碳与石灰水反应生成碳酸钙沉淀,如果二氧化碳过量则生成碳酸氢钙,D不正确,答案选A。
本题难度:一般
5、简答题 在水溶液中,YO3n-和S2-发生反应的离子方程式为:YO3n-+3S2-+6H+=Y-+3S↓+3H2O
(1)YO3n-中Y元素的化合价是______?(2)Y元素原子的最外层电子数是______.
参考答案:(1)离子方程式遵循电荷守恒,则在YO3n-+3S2-+6H+=Y-+3S↓+3H2O中:n+3×2-6=1,n=1,设YO3n-中Y元素的化合价为x,则-2×3+x=-1,x=+5,故答案为:+5;
(2)由离子方程式可知,Y的最低负价为-1价,则说明最外层含有7个电子,故答案为:7.
本题解析:
本题难度:一般