1、选择题 下列离子方程式中正确的是(?)
A.将金属钠加入水中 Na + 2H2O= Na+ + 2OH- + H2 ↑
B.氯气通入水中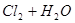

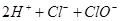
C.FeBr2溶液中加入过量的新制氯水 2Fe2++4Br-+3Cl2 =2Br2+6Cl-+2Fe3+
D.氯化铝溶液中加入过量氨水 A13++4NH3·H2O
参考答案:C
本题解析: A.将金属钠加入水中 Na + 2H2O= Na+ + 2OH- + H2 ↑,原子不守恒,错误;B. 氯气通入水中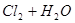

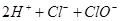 ,HClO是弱酸,不能拆,错误。C. FeBr2溶液中加入过量的新制氯水 2Fe2++4Br-+3Cl2 =2Br2+6Cl-+2Fe3+,两种离子二价铁离子和溴离子都被氧化,正确;D.氢氧化铝在弱碱氨水中不能溶解,错误;
,HClO是弱酸,不能拆,错误。C. FeBr2溶液中加入过量的新制氯水 2Fe2++4Br-+3Cl2 =2Br2+6Cl-+2Fe3+,两种离子二价铁离子和溴离子都被氧化,正确;D.氢氧化铝在弱碱氨水中不能溶解,错误;
本题难度:一般
2、简答题 某类化学反应可用如下通式表示:A+B→C+D+H2O?请按要求回答问题:
(1)若A、C、D中均含有氯元素,且A中的Cl的化合价介于C和D之间,写出该反应的离子方程式:______
(2)若A是紫红色金属,D为红棕色气体,写出该反应的化学方程式:______
(3)若C和D均为气体且都能使澄清的石灰水变浑浊,A呈固态,则B的化学式为______若产物D是还原产物,其化学式为______.
(4)若C是一种碱性气体,能使湿润的红色石蕊试纸变蓝,D是一种固体可作干燥剂(中性),则化学式依次为A(盐)______B______.
参考答案:(1)A、C、D中均含有氯元素,且A中的Cl的化合价介于C和D之间,该反应为氯气在碱性条件下的歧化反应,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)紫红色金属为Cu,红棕色气体为NO2,为铜和浓硝酸的反应,
反应的化学方程式为Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O;
(3)能使澄清的石灰水变浑浊的气体有和,应为碳和浓硫酸的反应,A呈固态,应为C,则B为浓硫酸,还原产物为SO2,
故答案为:H2SO4;SO2;
(4)碱性气体为NH3,为NH4Cl和Ca(OH)2的反应,故答案为:NH4Cl;Ca(OH)2.
本题解析:
本题难度:一般
3、选择题 将一定量的SO2通人Ba(NO3)2溶液中,下列离子反应一定不会发生的是
A.Ba2++SO2+H2O
B.Ba2++SO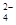
C.3SO2+2H2O+2NO3-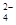 十4 H++2NO↑
十4 H++2NO↑
D.4SO2+5H2 O+NO3-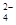 +NH4++6 H+
+NH4++6 H+
参考答案:A
本题解析:SO2和水反应可以生成H2SO3,溶液显酸性,Ba(NO3)2可以电离出NO3-,在酸性溶液中具有强氧化性,因此SO2与Ba(NO3)2不可能发生简单的复分解反应,A项错误。答案选A。
点评:NO3-在中性或碱性溶液中没有强氧化性,而在酸性溶液中具有强氧化性,因此还原性物质都不能大量共存。
本题难度:一般
4、选择题 下列反应的离子方程式正确的是?(?)
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O====Cl2↑+H2↑+2OH-
B.硫化钠发生水解:S2-+H2O=HS-+OH-
C.少量小苏打溶液滴入Ba(OH)2溶液中:HCO-3十Ba2++OH-= BaCO3↓+H2O
D.向NH4HSO4溶液中加入NaOH溶液至混合液为中性:H++OH-= H2O
参考答案:C
本题解析:略
本题难度:一般
5、简答题 在纯碱溶液中滴入酚酞,溶液变红.若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是______,其原因是______(以离子方程式和简要文字说明).
参考答案:纯碱是强碱弱酸盐碳酸钠,在纯碱溶液中CO32-易水解生成氢氧根离子:CO32-+H2O?HCO3-+OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,滴入酚酞,溶液变红;
向溶液中加入氯化钡后,钡离子和碳酸根离子反应生成碳酸钡沉淀,Ba2++CO32-═BaCO3↓(白色).由于CO32-浓度减小,水解平衡左移,OH-浓度减小,溶液中只有NaCl和BaCl2,呈中性,溶液褪色;
故答案为:产生白色沉淀,溶液由红色变为无色;CO32-水解呈碱性使酚酞变红:CO32-+H2O?HCO3-+OH-.加入BaCl2后,CO32-转化为BaCO3沉淀,水解平衡左移,OH-浓度减小,溶液中只有NaCl和BaCl2,呈中性,溶液褪色.
本题解析:
本题难度:一般