1、选择题 稀硫酸溶液与锌粒反应,为了减缓反应速率,可以采取的办法是
A.升高温度
B.加水稀释
C.改用锌粉
D.适当提高硫酸的浓度
参考答案:B
本题解析:
本题难度:困难
2、选择题 下列措施一定能使化学反应速率增大的是
A.增大反应物的量
B.增大压强
C.升高温度
D.减小反应物的浓度
参考答案:C
本题解析:增大反应物的“浓度”而不是“量”才能加快反应速率;增大压强必须通过增大反应物的浓度才能加快反应速率;减小反应物的浓度,化学反应速率减慢;升高温度一定能使化学反应速率增大.
本题难度:简单
3、选择题 在某一化学反应中,反应物B的浓度在5 s内从2.5 mol/L变成0.5 mol/L,在这5 s内B的化学反应速率为
A.0.4 mol/L
B.0.4 mol/L·s
C.0.4mol-1·L-1·s-1
D.0.4 mol/(L·s)
参考答案:D
本题解析:试题分析:反应速率通常用单位时间内浓度的变化量来表示,则该反应的反应速率是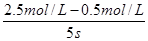 =0.4 mol/(L·s),答案选D。
=0.4 mol/(L·s),答案选D。
考点:考查反应速率的有关计算
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练,难度不大。该题的关键是明确反应速率的含义和计算依据,然后结合题意灵活运用即可,有利于培养学生规范的答题能力和逻辑推理能力。
本题难度:简单
4、选择题 一定条件下,合成氨达到平衡状态时,进行下列操作,平衡不发生移动的是
A.恒温恒压时,充入NH3
B.恒温恒容时,充入N2
C.恒温恒压时,充入He
D.恒温恒容时,充入He
参考答案:D
本题解析:在恒温恒压时,向平衡体系中充入NH3,体系压强由于分子数的增多而增大,容器将做等压膨胀,结果整个体系体积增大.由于加入的是生成物,实际上等于减小了反应物的浓度(反应物的体积增大,而物质的量没变),此时,正反应速率小于逆反应速率,平衡向左移.
在恒温恒容时,充入N2使容器内压强增大.由于整个体系体积不变,所以充入N2后,只有反应物N2的浓度增大,而生成物NH3的物质的量及体积都没变,所以平衡向右移动.
在恒温恒压时,充入He,使整个体系做等压膨胀,体积变大,He虽然不参与化学反应,但由于体积增大,使平衡混合物中的N2、H2、NH3的浓度都相应变小,结果反应物的浓度减小的程度比生成物浓度减小的程度大,此时正反应速率小于逆反应速率,平衡左移.
在恒温恒容时,充入He,使整个体系压强增大,但由于He不参与反应,对于反应物而言,它们的物质的量和体积都没有变化,所以浓度没变,故平衡不发生移动.
本题难度:一般
5、选择题 键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436KJ/mol、243KJ/mol和431KJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为
A.放热91.5KJ
B.放热183KJ
C.吸热183KJ
D.吸热91.5KJ
参考答案:A
本题解析:断开1molH-H、Cl-Cl所需要吸收的能量之和是436kJ+243kJ=679kJ。此时可以生成2molHCl,因此形成新化学键时放出的热量是2×431kJ=862kJ,所以反应实际放出的能量是862kJ-679kJ=183kJ。因此生成1molHCl放出的能量是183kJ ÷2=91.5KJ。答案是A。
本题难度:一般