1、选择题 下列解释实验现象的反应方程式不正确的是
A.新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-=Cl-+ClO-+H2O
B.向NaHCO3?溶液中滴加酚酞溶液,溶液变红HCO3-?H++CO32-
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2+2Fe3+=2Fe(OH)3↓+3Mg2+
D.向少量苯酚稀溶液中逐滴加入饱和溴水,生成白色沉淀
参考答案:B
本题解析:分析:A、新制氯水中滴加NaOH溶液后,氯气和氢氧化钠溶液反应生成氯化钠次氯酸钠和水;
B、碳酸氢根离子水解显碱性;
C、氯化铁水解显酸性能溶解氢氧化镁,促进铁离子水解,生成氢氧化铁沉淀;
D、苯酚和浓溴水发生取代反应反应生成白色沉淀;
解答:A、新制氯水中滴加NaOH溶液后,黄绿色褪去,是氯气和氢氧化钠反应,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;故A正确;
B、向NaHCO3 溶液中滴加酚酞溶液,溶液变红是因为碳酸氢根离子水解显碱性,反应的离子方程式为:H2O+HCO3-?OH-+H2CO3 ;故B错误;
C、向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀,反应的离子方程式为:3Mg(OH)2+2Fe3+=2Fe(OH)3↓+3Mg2+;故C正确;
D、向少量苯酚稀溶液中逐滴加入饱和溴水,生成白色沉淀,反应的化学方程式为; 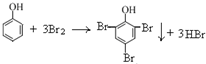 ,故D正确;
,故D正确;
故选B.
点评:本题考查了反应离子方程式的正误分析,书写方法,掌握反应实质是解题关键,题目难度中等.
本题难度:简单
2、选择题 下列叙述正确的是
A.H2热值为142.9kJ?g-1,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ?mol-1
B.Al3+、Cu2+、SO42-、F-能在溶液中大量共存
C.硫酸亚铁溶液在空气中发生氧化反应:4Fe2++O2+4H+=4Fe3++2H2O
D.已知KSP(Ag2SO4)=1.4×10-5,则向100mL 0.01mol?L-1的Na2SO4溶液中加入1mL 0.01mol?L-1的AgNO3溶液,有白色沉淀生成
参考答案:C
本题解析:分析:A、利用单位的不同,根据热值来计算反应热;
B、利用离子能否发生反应来分析离子的共存问题;
C、利用氧化还原反应来分析发生的反应,并利用电子守恒及电荷守恒来分析离子方程式;
D、根据离子积和溶度积来分析是否有沉淀生成.
解答:A、H2热值为142.9kJ?g-1,则氢气的燃烧热为142.9×2kJ/mol=285.8kJ?mol-1,则燃烧的热化学方程式可表示为H2(g)+ O2(g)=H2O(l)△H=-285.8kJ?mol-1,故A错误;
O2(g)=H2O(l)△H=-285.8kJ?mol-1,故A错误;
B、因Al3+、Cu2+与F-发生相互促进的水解而生成弱电解质,则该组离子不能大量共存,故B错误;
C、因亚铁离子具有还原性,能被空气中的氧气氧化,则发生反应4Fe2++O2+4H+=4Fe3++2H2O,遵循电子守恒和电荷守恒,故C正确;
D、因c(Ag+)2×c(SO42-)=(0.01)2×0.01<KSP(Ag2SO4)=1.4×10-5,则不会有沉淀生成,故D错误;
故选C.
点评:本题综合性较强,,考查了多个知识点,符合高考中的冷拼题,学生应注意及时转化思维来解答此类习题.
本题难度:困难
3、选择题 把0.05molNaOH固体加入到下列100ml液体中,溶液的导电能力变化不大的是
[? ]
A、水
B、0.5mol/L盐酸
C、0.5mol/L醋酸
D、0.5mol/LNH4Cl溶液
参考答案:BD
本题解析:
本题难度:一般
4、选择题 下列反应的离子方程式不正确的是
A.醋酸加入氨水:CH3COOH+NH3?H2OCH3COO-+NH4++H2O
B.铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag
C.碳酸钙加入醋酸:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
D.硫氰化钾溶液加入三氯化铁溶液:Fe3++SCN-=[Fe(SCN)]2+
参考答案:BC
本题解析:分析:A、醋酸和氨水属于弱电解质,醋酸铵属于可溶于水的盐;
B、离子方程式中,反应前后要遵循电荷守恒;
C、碳酸钙是一种难溶于水的沉淀,不能拆成离子形式;
D、硫氰根和三价铁之间发生络合反应.
解答:A、弱酸和弱碱之间反应生成的盐是易溶于水的物质,只有盐可以拆成离子形式,故A正确;
B、离子方程式中,反应前后要遵循电荷守恒,应为:Cu+2Ag+=Cu2++2Ag,故B错误;
C、碳酸钙是一种难溶于水的沉淀,不能拆成离子形式,应为:CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+,故C错误;
D、硫氰根和三价铁之间发生络合反应,可以络合的硫氰酸根个数为1~6,故D正确.
故选BC.
点评:本题考查学生离子方程式书写的正误判断方法,是现在高考的热点考题.
本题难度:简单
5、选择题 下列物质中,属于电解质的是
A.铜
B.乙醇
C.稀硫酸
D.氢氧化钾固体
参考答案:D
本题解析:溶于水或在熔融状态下能够导电的化合物是电解质,则氢氧化钾是电解质,铜是单质、稀硫酸是混合物,都既不是电解质,也不是非电解质。乙醇是非电解质,答案选D。
点评:该题是高考中的常见考点,侧重对学生灵活运用基础知识解决实际问题的能力的培养。该题的关键是明确电解质的判断依据是看化合物自身能否电离出离子,而导电只是一种实验现象,不能作为判断的依据。
本题难度:简单