1、填空题 工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
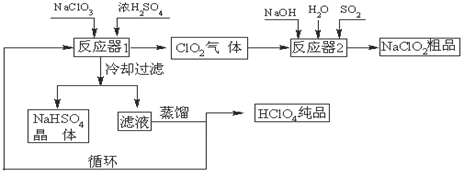
(1)冷却过滤的目的是降低NaHSO4的?,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为?,SO2的
作用是作?剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为?。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较?(填“高”或“低”),容易从溶液中逸出,循环使用的物质是?。
参考答案:(1)溶解度?(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;?还原
(3)1:2?(4)低? H2SO4
本题解析:(1)在反应器1中,硫酸钠和硫酸反应获得的硫酸氢钠的溶解度随着温度的降低而减小,这样冷却过滤,可以降低NaHSO4的溶解度并分离出NaHSO4晶体。
(2)在反应器2中,可以实现二氧化氯向NaClO2的转化,二氧化硫可以作为还原剂把ClO2还原为NaClO2,反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O。
(3)根据方程式3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O可知,NaClO3既是氧化剂,也是还原剂,其中氯元素的化合价从+5价部分升高到+7价,部分降低到+4价,所以高氯酸是氧化产物,二氧化氯是还原产物。根据电子得失守恒可知,氧化产物与还原产物的物质的量之比为1:2。
(4)可以通过蒸馏滤液的方法得到高氯酸,这说明高氯酸的沸点比较低(沸点:90oC);根据循环图可以发现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,可以循环使用。
本题难度:一般
2、填空题 (10分)某地区用含较多Ca2+,Mg2+的天然水按照下列步骤制取蒸馏水。请回答下列问题。步骤:天然水→①沉降→②过滤→③曝气→④离子交换→⑤消毒→纯净水
(1)该地区的天然水属于?(“硬水”或“软水”)。
(2)在第①步中需要加入凝聚剂,常用的凝聚剂可以是?。
(3)经过第④步离子交换后要经过杀菌消毒才能直接饮用。常用的消毒方式有?。
(4)若采用药剂法软化天然水,可以向其中加入碳酸钠,发生反应的离子反应方程式是?
?,如果是暂时硬度,可用加热的方法除去,请写出发生的化学反应方程式? ?(写出一个即可)。
?(写出一个即可)。
参考答案:

本题解析:略
本题难度:一般
3、选择题 在水玻璃中通入足量的CO2气体,充分反应后,加热蒸发,再高温灼烧,则最后所得的固体物质为( )
A.Na2SiO3
B.SiO2与Na2CO3
C.SiO2
D.SiO2与NaHCO3
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列属于直接利用太阳能的是
①光-热转换②光-电转换③光—化学能转换④光-生物质能转换
A.①②③
B.①③④
C.①②④
D.①②③④
参考答案:D
本题解析:略
本题难度:简单
5、选择题 下列关于复合材料的说法不正确的是
[? ]
A、金属材料不能制成复合材料
B、玻璃钢是日常生活中常用的复合材料,其强度可超过合金钢
C、跳高运动员用的撑杆为复合材料制作
D、复合材料具有不可估量的应用前景,人类已从合成材料时代进入复合材料时代
参考答案:A
本题解析:
本题难度:简单