| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《原电池原理》试题预测(2020年最新版)(二)
参考答案:B 本题解析:原电池中较活泼的金属作负极,失去电子,发生氧化反应,溶液中的阳离子在正极得到电子,发生还原反应,电极本身得到保护,不易腐蚀,将A与B用导线连接起来,浸入电解质溶液,B不易腐蚀,说明金属性A大于B;将A,D分别投入等浓度的盐酸中,D比A反应剧烈,说明金属性D大于A,将铜浸入B的盐溶液中,无明显变化,若将铜浸入C的盐溶液中,有金属C析出,说明B的金属性强于铜,而铜的金属性强于C,所以这四种金属的活动性由强到弱的顺序是D>A>B>C,选B。 本题难度:一般 3、选择题 工业上先后用下列方法制备金属钠:
③电解熔融氯化钠. 下列有关说法正确的是( ) A.电解熔融氢氧化钠制钠的反应为:4NaOH(熔)?
B.在电解熔融氯化钠的电解槽(如图)中,石墨为阳极,铁为阴极 C.电解熔融氯化钠时,Na+向阳极移动 D.方法①与②制得等量的钠,两反应中转移的电子总数相等 |
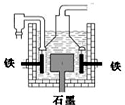
参考答案:B
本题解析:
本题难度:简单
4、选择题 生物体中细胞膜内的葡萄糖与细胞膜外的富氧体液及细胞膜构成原电池。下列有关电极反应及产物的判断正确的是
[? ]
A.负极反应可能是O2+2H2O+4e-==4OH-
B.负极反应的产物主要是C6H12O6被氧化成CO32-、HCO3-和H2O
C.正极反应可能是C6H12O6+24OH--24e-==6CO2↑+18H2O
D.正极反应的产物主要是葡萄糖生成的CO2、HCO3-和H2O
参考答案:B
本题解析:
本题难度:一般
5、选择题 有A、B、C、D四种金属.将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀.将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈.将铜浸入B的盐溶液中,无明显变化.如果把铜浸入C的盐溶液中,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C
参考答案:两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B.
金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜.如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C.
所以金属的活动性顺序为:D>A>B>C,故选B.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学反应与.. | |