1、填空题 (1)用金属钠制取过氧化钠的化学方程式是 ____,现象是____。
(2)已知用金属钠生成氧化钠,可有多种方法:
①4Na+ O2=2Na2O;②4Na+CO2=2Na2O+C;③2NaNO2+ 6Na=4Na2O+N2↑。
在上述三种方法中最好的方法是 ____,原因是____。
参考答案:(1)2Na+O2 Na2O2? ;产生黄色火焰,生成淡黄色固体
Na2O2? ;产生黄色火焰,生成淡黄色固体
(2)③;此反应中产物只有Na2O是固体,而且另一产物 N2可以把周围环境中的氧气排净,使得Na2O不被氧化成Na2O2
本题解析:
本题难度:一般
2、选择题 下列物质不能用单质直接化合而制得的是( )
①Na2O2②FeCl3③NO2④Mg3N2⑤SO3⑥CO.
A.①③
B.②④
C.③⑤
D.④⑥
参考答案:①钠与氧气反应分两种,一种是在氧气中燃烧,剧烈燃烧生成淡黄色的过氧化钠;一种是在常温下与氧气反应,生成白色的氧化钠.故①错误;
②氯气是强氧化剂,可以直接将铁单质氧化为最高价+3价,无论氯气的量是否足量,均生成氯化铁.故②错误;
③在放电条件下,氮气可以和氧气化合生成一氧化氮:N2+O2?放电?.?2NO,一氧化氮与氧气迅速化合,生成二氧化氮:2NO+O2=2NO2,故③正确;
④在点燃的条件下,氮气与镁反应生成氮化镁:Mg3N2,故④错误;
⑤硫在空气中点燃生成淡蓝色火焰,在氧气中生成蓝紫色火焰,生成SO2 ,不生成SO3,故⑤正确;
⑥碳在空气中燃烧,有耀眼的黄色火焰,生成CO2,燃烧不完全生成CO,故⑥错误;
故选C.
本题解析:
本题难度:简单
3、选择题 把金属钠投入到下列物质的溶液中,溶液质量减轻的是( )
A.HCl
B.Na2SO4
C.NH4Cl
D.CuSO4
参考答案:A、钠投入盐酸中溶液中发生反应2Na+2H+=Na++H2↑,由方程式可知每46g钠反应生成2g氢气,溶液质量增重44g,故A不符合;
B、钠投入Na2SO4溶液中,发生反应2Na+2H2O=2NaOH+H2↑,由方程式可知每46g钠反应生成2g氢气,溶液质量增重44g,故B不符合;
C、钠投入氯化铵溶液中,钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和氯化铵反应,反应方程式为:NaOH+NH4Cl=NH3↑+NaCl+H2O,将两个方程式相加得2Na+2NH4Cl=H2↑+2NH3↑+2NaCl,根据方程式知,每46g钠反应生成2g氢气、34g氨气,溶液质量增重10g,故C不符合;
D、钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和硫酸铜反应,反应方程式为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,将两个方程式相加得2Na+2H2O+CuSO4=H2↑+Na2SO4+Cu(OH)2↓,根据方程式知,每46g钠反应生成2g氢气、98g氢氧化铜沉淀,溶液质量减轻2g+98g-46g=54g,故D符合;
故选D.
本题解析:
本题难度:一般
4、简答题 臭氧是一种强氧化剂,常用于消毒、灭菌等.
(1)O3与KI溶液反应生成的两种单质是______和______.(填分子式)
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.已知:O3的起始浓度为0.0216mol/L.
pH
t/min
T/℃ | 3.0 | 4.0 | 5.0 | 6.0
20
301
231
169
58
30
158
108
48
15
50
31
26
15
7
|
①pH增大能加速O3分解,表明对O3分解起催化作用的是______.
②在30℃、pH=4.0条件下,O3的分解速率为______mol/(L?min);
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字母代号)
a.?40℃、pH=3.0? b.?10℃、pH=4.0? c.?30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为______(填“A”或“B”),其电极反应式为______.
②若C处通入O2,则A极的电极反应式为______.
③若C处不通入O2,D、E处分别收集到x?L和y?L气体(标准状况),则E处收集的气体中O3所占的体积分数为______(忽略O3的分解).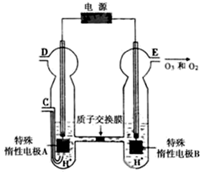
参考答案:(1)O3与KI溶液反应生成的两种单质只能为O2、I2,故答案为:O2;I2;
(2)①pH增大,则OH-浓度增大,pH增大能加速O3分解,表明对O3分解起催化作用的是OH-,故答案为:OH-;?
②v=△ct=0.0108mol/L108min=1.00×10-4mol/(L?min),故答案为:1.00×10-4;?
③由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231nin;
30°C、pH=7.0时,所需时间<7min,则分解速率依次增大的顺序为b、a、c,
故答案为:b、a、c.
(3))①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑;
故答案为:A;2H++2e-═H2↑;
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
③若C处不通入O2,实质为电解水,D处为氢气,体积为x?L,E处为氧气、臭氧,体积共为y?L,令臭氧的体积为ZL,根据电子转移守恒有
x×2=Z×3×2+(y-Z)×2×2,解得Z=x-2y,所以E处收集的气体中O3所占的体积分数为x-2yy,
故答案为:x-2yy.
本题解析:
本题难度:一般
5、选择题 将等物质的量的①Na、②Na2O、③Na2O2、④NaOH投入到等体积且足量的水中,得到四种溶,其中说法正确的是( )
A.①、②、③、④溶质的质量分数相等
B.②、③溶质的物质的量浓度相等
C.①溶质质量分数最大,④溶质的质量分数最小
D.无法确定①、②、③、④四种溶液溶质的质量分数的大小
参考答案:首先,等物质的量(假设是1mol)的①Na、②Na2O、③Na2O2、④NaOH中Na2O2和Na2O都含有2molNa,所以这两种物质形成的溶液中溶质的物质的量浓度最大,并且Na2O2和水反应生成了O2,所以相当于Na2O,两者是等价的,即氧化钠和过氧化钠所得溶质的物质的量浓度相等,等物质的量的Na质量比NaOH小,且金属钠和水反应生成H2,所以所得溶质的物质的量浓度是Na>NaOH,即得到四种溶液中溶质的物质的量浓度关系是Na2O=Na2O2>Na>NaOH,即②=③>①>④.
故选B.
本题解析:
本题难度:简单