1、选择题 混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积比为
A.1:1
B.1:4
C.4:1
D.1:2
参考答案:B
本题解析:分析:根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算混合气体中N2和CH4的体积比.
解答:混合气体在标准状况下的密度为0.821g/L,
则混合气体的平均摩尔质量为0.821g/L×22.4L/mol=18.4g/mol.
根据十字交叉法计算混合气体中N2和CH4的体积比:
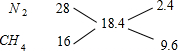
所以混合气体中N2和CH4的体积比为2.4:9.6=1:4.
故选B.
点评:本题考查混合物的计算,难度中等,本题采取十字交叉法计算,简化计算.采取常见解法,容易理解,但计算繁琐,容易出错.
本题难度:简单
2、选择题 下列涉及有机物的性质或应用的说法,不正确的是
A.苯、乙醇和乙酸都能发生取代反应
B.用新制的Cu(OH)2可检验尿液中的葡萄糖
C.甲烷和氯气的混合气体在光照下反应生成的是一氯甲烷和氯化氢
D.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
参考答案:C
本题解析:
本题难度:简单
3、选择题 中学化学常见的物质中,下列转化一定是氧化还原反应的是
A.含同种元素的氧化物之间的转化反应
B.含同种元素的含氧酸之间的转化反应
C.含同种金属元素的氢氧化物之间的转化反应
D.含同种金属元素的盐之间的转化反应
参考答案:C
本题解析:分析:含元素化合价变化的反应一定为氧化还原反应,以此来解答.
解答:A.含同种元素的氧化物之间的转化反应,如2NO2?N2O4,不存在元素的化合价变化,不属于氧化还原反应,故A不选;
B.含同种元素的含氧酸之间的转化反应,如H4SiO4 H2SiO3+H2O,Si元素的化合价不变,不属于氧化还原反应,故B不选;
H2SiO3+H2O,Si元素的化合价不变,不属于氧化还原反应,故B不选;
C.含同种金属元素的氢氧化物之间的转化反应,如4Fe(OH)2+O2+2H2O═4Fe(OH)3,Fe元素的化合价变化,属于氧化还原反应,故C选;
D.含同种金属元素的盐之间的转化反应,如AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,Al元素的化合价不变,不属于氧化还原反应,故D不选;
故选C.
点评:本题考查氧化还原反应,明确涉及的化学反应和具体的实例是解答本题的关键,能举出合适的例子是解答的难点,题目难度中等.
本题难度:一般
4、选择题 下列离子方程式书写正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓
B.稀硝酸中加入少量碳酸亚铁:FeCO3+2H+→Fe2++CO2↑+H2O
C.硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H++OH-═H2O
D.饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO32-+CO2+H2O═2NaHCO3↓
参考答案:CD
本题解析:分析:A.漏写生成氢氧化铜的离子反应;
B.发生氧化还原反应硝酸铁、NO、二氧化碳、水;
C.滴入几滴氢氧化钠溶液,先发生氢离子与碱的反应;
D.饱和碳酸钠溶液中生成碳素氢钠,其溶解度小,析出晶体.
解答:A.硫酸铜溶液与氢氧化钡溶液反应的离子反应为Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故A错误;
B.稀硝酸中加入少量碳酸亚铁的离子反应为3FeCO3+NO3-+10H+═3Fe3++3CO2↑+5H2O+NO↑,故B错误;
C.硫酸氢铵溶液中滴入几滴氢氧化钠溶液的离子反应为H++OH-═H2O,故C正确;
D.饱和碳酸钠溶液中通入二氧化碳气体的离子反应为2Na++CO32-+CO2+H2O═2NaHCO3↓,故D正确;
故选CD.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意选项B为解答的难点,选项D为易错点,题目难度中等.
本题难度:一般
5、选择题 下列空气污染物与其主要来源不对应的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:A.二氧化硫来源主要是矿物燃料的燃烧;
B.甲醛主要来源于复合地板,油漆,涂料及其他化学制品.
C.大气中氮氧化物的主要来源是燃煤、汽车尾气排放;
D.悬浮颗粒物来源主要是化石燃料的燃烧和扬尘
解答:A.二氧化硫来源主要是煤燃料产生的废气,故A错误;
B.甲醛主要来源于用复合地板,油漆,涂料制成的人造家具、用具,故B正确;
C.大气中氮氧化物的主要来源是燃煤、汽车尾气排放,故C正确;
D.悬浮颗粒物来源主要是化石燃料的燃烧和施工产生的扬尘,故D正确;
故选:A;
点评:本题考查常见的生活环境的污染治理,题目难度不大,注意污染物的来源.
本题难度:简单